AI, EBRT und Co – Zukunft des Stagings beim muskelinvasiven Blasenkarzinom
Bericht: Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Rahmen des Michael J. Marberger Meetings wurde Zukunftsweisendes zum Einsatz von Artificial Intelligence (AI) beim Blasenkarzinom präsentiert. Es tut sich aber auch einiges abseits dieses allgegenwärtigen Themas, wie unser Bericht zeigt.
Keypoints
-
Um die Artificial Intelligence als Standard of Care in der Histopathologie zu etablieren, bedarf es noch vieler Validierungsstudien.
-
Beim nichtmuskelinvasiven Blasenkarzinom sollte standardmäßig eine En-Bloc-Resektion des Blasentumors durchgeführt werden.
-
Der Einsatz von nichtbildgebenden Verfahren zusätzlich zur Bildgebung dürfte vielversprechend sein, um beim muskelinvasiven Blasenkarzinom die Qualität der Therapie zu verbessern.
Einsatz der AI in der Histopathologie
In den vergangenen 10–15 Jahren hat sich vor allem beim Harnblasenkarzinom (BC) sehr viel im Bereich der molekularen Klassifikation getan. AI spielt in der molekularen Pathologie eine große Rolle, jedoch gibt es noch Hürden zu überwinden, damit sie noch effektiver zum Einsatz kommen kann. Univ.-Prof. Dr. Eva Compérat, MedUni Wien, veranschaulichte das folgendermaßen: „Deep-Learning-Algorithmen extrahieren relevante Merkmale von Rohdaten. Die daraus generierten Antworten basieren auf einem statistischen Modell und stellen insofern eine Black Box dar, als auch die AI nicht in der Lage ist, die Ergebnisse zu erklären. Zurzeit wird viel geforscht, um diese Black Box zu eliminieren.“
Anhand von Studien zum BC gab Compérat einen Überblick über den Status quo, was mittels AI bereits untersucht worden ist. Daraus geht hervor, dass die Ergebnisse großteils noch verbesserungswürdig sind und viele Studienergebnisse noch einer Validierung bedürfen. So wurde eine Studie zum Grading von NMIBC (nicht muskelinvasives BC) durch AI vs. die Beurteilung durch drei Pathologen (Konsensus und individuell) durchgeführt. Durch die automatische Klassifikation wurden 71% der High-Grade- und 76% der Low-Grade-Karzinome richtig eingestuft. „Diese Ergebnisse sind nicht schlecht, aber auch nicht außergewöhnlich. Ich denke, dass wir Pathologen das besser können“, merkte Compérat dazu an.
Das automatisierte Grading zeigte nur moderate Übereinstimmung mit dem Konsensus und die Übereinstimmung zwischen den Pathologen reichte von angemessen bis moderat.1
Kombination von AI mit klinischen Daten
Vielversprechender sind die Ergebnisse zur Prädiktion eines Rezidivs bei NMIBC-Patient:innen (n=157) mittels „multiple instance survival learning“ (MISL). Das beste Modell zeigte einen unabhängigen prognostischen Wert im Kontext von Variablen wie Tumorstadium, Grad und Vorliegen von Tumor bei wiederholter transurethraler Blasentumorresektion (TURBT) mit einer statistisch signifikanten Risikostratifikation der Patient:innen (p=0,0161).2 Wenn in Validierungsstudien die Generalisierbarkeit dieser Modelle bestätigt werden könnte, wäre das MISL-System ein hilfreiches Tool zur Rezidivvorhersage.
Dass die Kombination von digitalisierten histopathologischen Slides mit klinischen Daten zur Prädiktion eines Rezidivs genutzt werden kann, geht auch aus einer anderen Studie hervor:
Die Area under the Curve (AUC) des Modells zur Kombination der digitalisierten Slides unter Verwendung von Deep Learning mit den klinischen Daten war höher und die Präzision der Vorhersage höher als bei alleiniger Anwendung der Slides bzw. klinischen Daten.3
Bezüglich der Bestimmung der PD-L1-Expression auf Tumorzellen zur Lenkung der Entscheidung für eine Immuntherapie (IO) kommt häufig die Immunhistochemie zum Einsatz, wobei die Interpretation sehr komplex und zeitaufwendig ist. Insofern könnten sich AI-basierte Algorithmen für das Scoring als hilfreich erweisen. In einer multinationalen Studie wurde die PD-L1-Expressionsbestimmung auf BC-Zellen durch ein AI-Messmodell (AIM) mit der Interpretation durch Pathologen mit entsprechender Expertise verglichen.
Insgesamt waren die Ergebnisse zwischen Pathologen und AIM vergleichbar, somit könnten in Zukunft AI-Algorithmen als ein wertvolles Referenztool zum Einsatz kommen.4 „Es gibt sehr viele Möglichkeiten, um AI einzusetzen, jedoch ist auch noch viel Validierung erforderlich!“, so Compérat abschließend.
EBRT als SOC bei CIS und TaT1-Tumoren
Ca. 75% der BC sind auf die Mukosa beschränkt und werden demnach als Carcinoma in situ (CIS) oder Stadium TaT1 klassifiziert.5 Prof. Dr. Dmitry Enikeev, MedUni Wien und Setschenov-Universität, Moskau, referierte über die Vorteile einer En-Bloc-Resektion (EBRT) von nichtmuskelinvasiven Blasenkarzinomen (NMIBC). Diese wird in den Guidelines der European Association of Urology (EAU) als Standard of Care (SOC) empfohlen.5
Bereits im Jahr 2011 haben Wolters et al. das zunehmende Interesse an EBRT-Techniken erwähnt und konnten in einer Studie eine geringe perioperative Morbidität, präzises pathologisches Staging sowie Sicherheit und Effektivität dieses Verfahrens bestätigen.6
Enikeev führte als Vorteile der EBRT vs. eine TURB bessere onkologische Outcomes an und hob hervor, dass sie mit keinerlei Einschränkungen hinsichtlich Lokation und Tumorgröße einhergeht. Wie eine Online-Befragung ergeben hat, wird sie auch von Pathologen bevorzugt, da EBRT-Proben rascher, genauer und kosteneffektiver befundet werden können.7
Die höhere Sicherheit im Sinne einer geringeren Komplikationsrate vs. eine konventionelle TURBT wurde auch in einer Metaanalyse von 19 Studien bestätigt: Die EBRT ging mit einer signifikant kürzeren Katheterisierungs- und Hospitalisierungszeit, einer geringeren Zahl an Reflexauslösungen am Nervus obturatorius und Blasenirritationen und -perforationen einher. Außerdem war die Rezidivrate nach einem medianen Follow-up von 15 Monaten mit 13 vs. 18% unter der EBRT niedriger (p=0,16).8 Dass die onkologischen Outcomes in den meisten Studien nur numerisch besser waren, führte Enikeev auf die unterschiedlich große Expertise der durchführenden Urolog:innen zurück.8
Aufgrund des Mangels an kontrollierten randomisierten Studien zur EBRT vs. TURBT hat im Jahr 2020 ein Expertenkommitee bestehend aus Onkolog:innen, Urolog:innen und Patholog:innen ein internationales Konsensusstatement zu dieser Thematik publiziert und sich darauf geeinigt, dass auch Tumoren >3cm einer EBRT zugeführt werden können, d.h., dass auch die Größe keine Limitation bedeutet.9 Inzwischen liegen auch Ergebnisse einer prospektiven Studie zum Vergleich der EBRT mit der TURBT bei großen NMIBC (≥3cm) vor: Die Autoren erachteten die EBRT auch bei großen NMIBC als sichere und durchführbare Strategie, die zu einer höheren Probenqualität führt und mit einer höheren Wahrscheinlichkeit der kompletten Tumoreradikation einhergeht.10
FDG-PET/CT – Zusatznutzen beimMIBC-Staging?
Die Uroonkologin Dr. Laura Mertens, Netherlands Cancer Institute, Amsterdam, ist der Frage nach der Zukunft des Stagings beim MIBC nachgegangen und hat in diesem Kontext die Verbesserung der Therapie als oberste Priorität angeführt. „Die Patient:innen benötigen ein besseres Staging vor der Therapie. Es stellt sich die Frage, ob sich die metabolische Bildgebung – die bei anderen Tumorentitäten eine zentrale Rolle spielt – als hilfreich erweisen könnte“, so die Überlegungen von Mertens. In den EAU-Guidelines zum MIBC wird für das lokale Staging ein MRI und bei bestätigtem MIBC für das Screening auf Metastasen ein CT empfohlen.11
In einem Review zur Erfassung des Zusatznutzens einer FDG-PET/CT-Untersuchung zu einem kontrastverstärkten CT (CECT) wurde dargelegt, dass das FDG-PET/CT in den meisten Studien bei der Lymphknotenevaluierung zum Einsatz kam und mit diesem eine höhere Sensitivität einherging. Ein Zusatzwert zum CECT wurde auch bei Rezidiven identifiziert und führte häufig zu Änderungen im Patient:innenmanagement.12
Die höhere Sensitivität des FDG-PET/CT wurde auch in einer weiteren Untersuchung bestätigt, zu der Daten zum Staging vor Therapieinitiierung vorliegen: Es liefert wichtige Staginginformationen zu Fernmetastasen, was bei 26% der Patient:innen zu einem Upstaging und bei 18% zu Änderungen der Therapieentscheidung geführt hat. 9% der Patient:innen, die zuvor als kurativ eingestuft worden waren, waren aufgrund der Upstagings durch die FDG-PET/CT-Ergebnisse ins palliative Setting geswitcht. Die Autoren befürworten aus diesen Gründen die Durchführung eines FDG-PET/CT13 und aus denselben Gründen äußerte sich Mertens kritisch dazu. Sie gab zu bedenken, dass eine falsch positive Anreicherung in der Prostata, wie es bei ca. 30% in dieser Studie der Fall war, zu Therapieverzögerungen führt. Zudem konnte bislang nicht gezeigt werden, dass zusätzliches Staging mit einem längeren Gesamtüberleben (OS) oder einer besseren Lebensqualität einhergeht, so Mertens.
Zusatznutzen durch perioperativeIO?
Eine neoadjuvante platinbasierte Chemotherapie (NACT) gefolgt von einer radikalen Zystektomie (RC) ist der SOC bei MIBC-Patient:innen. In der offenen, randomisierten Phase-III-Studie NIAGARA wurde untersucht, ob bei Cisplatin-geeigneten MIBC-Patient:innen durch die Zugabe von Durvalumab (D) zur NACT und die adjuvante Fortsetzung von D vs. die alleinige NACT Verbesserungen im OS und ereignisfreien Überleben (EFS) erzielt werden können. In beiden Endpunkten wurde eine signifikante Überlegenheit im D-haltigen vs. den Kontrollarm erzielt. Das EFS nach 24 Monaten wurde mit 67,8 vs. 59,8% (p<0,001), das OS mit 82,2 vs. 75,2% (p=0,01) berechnet.14 „Zurzeit sind viele Studien zur perioperativen Therapie im Gange. Man erhofft sich dadurch eine stärkere und länger anhaltende Response und eventuell auch die Vermeidung einer RC bei Erreichen einer pCR“, ergänzte Mertens.
ctDNA lenkend für die Gabe eineradjuvanten IO?
„Wir erhoffen uns, dass mittels Bildgebung sämtliche Läsionen ersichtlich sind, aber wahrscheinlich sehen wir nur die Spitze des Eisbergs. Vielleicht ist es Zeit, zu realisieren, dass die Bildgebung alleine nicht ausreichend ist, wir sollten sie mit nichtbildgebenden Verfahren wie der Messung der ctDNA (zirkulierende Tumor-DNA) kombinieren“, gab Mertens zu bedenken.
In der offenen Studie IMvigor010 konnte gezeigt werden, dass im Observationsarm das OS von Patient:innen mit dem Nachweis einer ctDNA-Positivität kürzer war als das von jenen, die nach der RC ctDNA-negativ waren. Durch die adjuvante Gabe von Atezolizumab wurde in diesem Kollektiv ein längeres OS erzielt. Demzufolge könnten mittels ct-DNA-Messung nach der RC Patient:innen identifiziert werden, die von einer adjuvanten IO profitieren.15 Zurzeit sind einige Studien im Gange, in denen diese Strategie untersucht wird (z.B. IMvigor011 [NCT04660344] oder TOMBOLA [NCT04138628]).
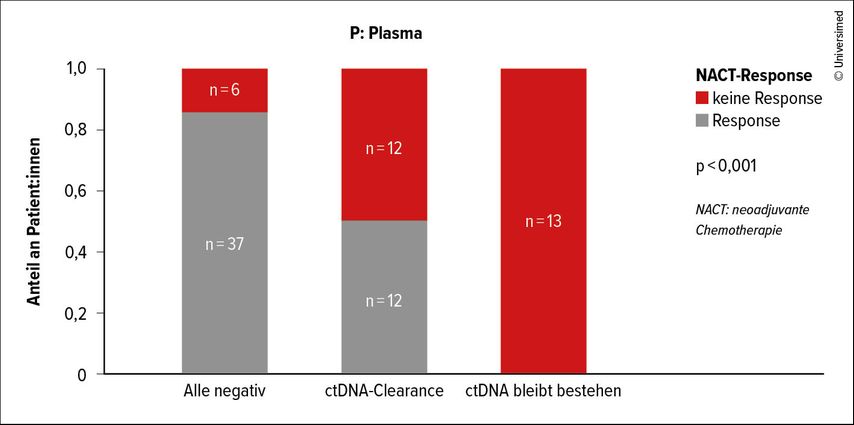
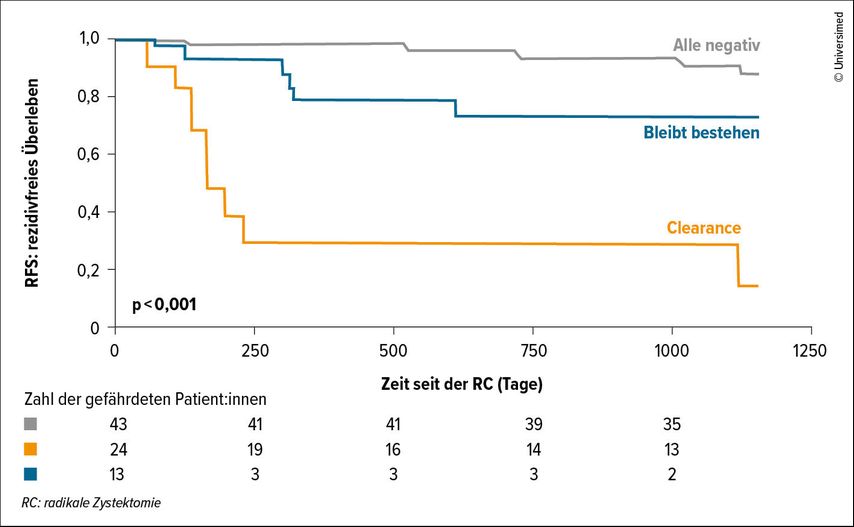
Für die Korrelation zwischen ctDNA-Level und „tumor-derived“ DNA-Response (tdDNA-Response) auf die NACT liegen bereits Ergebnisse vor: So wurde in einer dänischen Studie nachgewiesen, dass die Detektion von ctDNA vor der NACT mit einem signifikant geringeren Therapieansprechen einhergeht (p<0,001) (Abb. 1). Die tdDNA-Dynamik während der NACT war ebenfalls prädiktiv für die NACT-Response und auch das RFS nach der RC (p<0,001) (Abb. 2). 16 Resümierend sprach sich Mertens in Bezug auf die Zukunft des Stagings beim MIBC für die Kombination von Bildgebung mit nichtbildgebenden Methoden aus, merkte jedoch an, dass bislang noch kein Goldstandard existiert.
Abb. 1: Assoziation zwischen ct-DNA vor der NACT und der Response (modifiziert nach Christensen E et al. 2023)16
Quelle:
10th Michael J. Marberger Annual Meeting, 13. Dezember 2024, Wien
Literatur:
1 Jansen I et al.: Automated detection and grading of non-muscle-invasive urothelial cell carcinoma of the bladder. Am J Pathol 2020; 190(7): 1483-90 2 Drachneris J et al.: Prediction of non-muscle invasive papillary urothelial carcinoma relapse from hematoxylin-eosin images using deep multiple instance learning in patients treated with bacille calmette-guérin immunotherapy. Biomedicines 2024; 12(2): 360 3 Lucas M et al.: Deep learning-based recurrence prediction in patients with non-muscle-invasive bladder cancer. Eur Urol Focus 2022; 8(1): 165-72 4 Rüschoff J et al.: Scoring PD-L1 expression in urothelial carcinoma: an international multi-institutional study on comparison of manual and artificial intelligence measurement model (AIM-PD-L1) pathology assessments. Virchows Arch 2024; 48(4): 597-608 5 EAU Guidelines NMIBC 2024: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Non-muscle-Invasive-Bladder-Cancer-2024.pd f 6 Wolters M et al.: Tm:YAG laser en bloc mucosectomy for accurate staging of primary bladder cancer: early experience. World J Urol 2011; 29(4): 429-32 7 Guven S et al.: How do endoscopic bladder tumor resection techniques affect pathology practice? EAU Section of Uro-Technology (ESUT) and Uropathology (ESUP) survey. World J Urol 2022; 41(10): 2617-25 8 Zhang D et al.: Safety and efficacy of en bloc transurethral resection versus conventional transurethral resection for primary nonmuscle-invasive bladder cancer: a meta-analysis. World J Surg Oncol 2020; 18(1): 4 9 Teoh J et al.: An international collaborative consensus statement on en bloc resection of bladder tumour incorporating two systematic reviews, a two-round delphi survey, and a consensus meeting. Eur Urol 2020; 78(4): 546-69 10 Petov V et al.: Prospective non-randomized comparison of transurethral laser en bloc resection vs. conventional resection of bladder tumors larger than 3 cm. Minerva Urol Nephrol 2024; 76(4): 436-41 11 EAU Guidelines MIBC 2024: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Muscle-Invasive-and-Metastatic-Bladder-Cancer-2024.pdf 12 Einerhand SMH et al.: 18F-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography in muscle-invasive bladder cancer. Curr Opin Urol 2020; 30(5): 654-64 13 Voskuilen CS et al.: Staging 18F-fluorodeoxyglucose positron emission tomography/computed tomography changes treatment recommendation in invasive bladder cancer. Eur Urol Oncol 2022; 5(3): 366-9 14 Powles T et al.: Perioperative durvalumab with neoadjuvant chemotherapy in operable bladder cancer. N Engl J Med 2024; 391(19): 1773-86 15 Powles T et al.: Updated overall survival by circulating tumor DNA status from the Phase 3 IMvigor010 trial: Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma. Eur Urol 2024; 85(2): 114-22 16 Christensen E et al.: Cell-free urine and plasma DNA mutational analysis predicts neoadjuvant chemotherapy response and outcome in patients with muscle-invasive bladder cancer. Clin Cancer Res 2023; 29(8): 1582-91
Das könnte Sie auch interessieren:
Organisiertes Prostatakrebs-Screening inÖsterreich
Das Prostatakarzinom ist die häufigste Krebserkrankung bei Männern in Österreich und eine der Hauptursachen für krebsbedingte Todesfälle weltweit. Die europäischen Leitlinien empfehlen ...
mCRPC – State of the Art, und was kommt 2025?
In den letzten Jahren haben sich neben der Chemotherapie mit Docetaxel und Cabazitaxel und den beiden „new hormonal agents“ (NHA) Enzalutamid sowie Abirateron nun die PARP-Inhibitoren ...
Update zum Nierenzellkarzinom vom ASCO GU 2025
Der diesjährige ASCO GU wurde von 14. bis 16.2.2025 in San Francisco abgehalten. Die Veranstaltung hat sich im Laufe vieler Jahre als eine der wichtigsten uroonkologischen Plattformen ...