PIRADS III – Biopsie ja oder nein?
Autoren:
Dr. Gabor Rosta
Dr. Simon Turba
Universitätsklinikum St. Pölten – Lilienfeld
Standort St. Pölten
Karl-Landsteiner-Privatuniversität für Gesundheitswissenschaften
E-Mail: gabor.rosta@stpoelten.lknoe.at
Nach nationalen und internationalen Leitlinien besteht die Empfehlung, sowohl bei Biopsie-naiven als auch bei bereits biopsierten Patienten eine multiparametrische MRT (mpMRT) der Prostata vor der Biopsie durchzuführen.1 Die Zahl der Röntgeninstitute, die diese Untersuchung anbieten, steigt kontinuierlich, die Qualität der Untersuchung und der Befundung ist aber sehr heterogen. Nicht selten begegnen wir einem unklaren PIRADS-III-Befund. Wie können wir eine genauere Patientenselektion erreichen und falsch negative Befunde vermeiden, ohne das Ziel aus den Augen zu verlieren?
Keypoints
-
PIRADS-III-Läsionen stellen häufig eine klinische Herausforderung in der Bewertung der Notwendigkeit einer Biopsie dar.
-
Prostatabiopsien bleiben unangenehme, invasive Untersuchungen, die Patienten gerne vermeiden würden.
-
Die Kombination von PIRADS und PSA-Dichte (PSA-D) kann für die Aufklärung der Patienten über das Prostatakarzinomrisiko verwendet werden.
Die mpMRT der Prostata ist mittlerweile als Standardmethode in der Diagnostik von Prostatakrebs fest etabliert. Bei immer besserer Zugänglichkeit bleibt aber die Spezifizität für klinisch signifikante Tumoren bei nur 37%, wie die Daten aus der Cochrane-Metaanalyse zeigen.2 Um auf zahlreiche unnötige Biopsien zu verzichten, besteht der Bedarf, weitere Tools im diagnostischen Pfad zu verwenden und damit die Patientenselektion zu verfeinern.
Mögliche Tools
Mittlerweile stehen bereits verschiedene praxisnahe sowie auch eher akademische prädiktive Tools und Rechner zur Verfügung, die bei der Indikationsfindung einer Biopsie unterstützend herangezogen werden können.
-
Digitale rektale Untersuchung (DRU): sowohl für sich stehend als natürlich auch in Kombination mit anderen Faktoren. In Kombination mit einem erhöhten PSA-Wert verdoppelt sich die Wahrscheinlichkeit einer positiven Biopsie.3 Aus der Kombination eines suspekten Tastbefunds mit PIRADS III ergibt sich bei über 70-jährigen Patienten ein circa 20%iges Risiko für ein klinisch signifikantes Prostatakarzinom (16% bei niedriger PSA-Dichte [PSA-D] und 24% bei hoher PSA-D).4
-
Biomarker: Eine Studie über die Kombination von „neutrophil-to-lymphocyte ratio“ (NLR) und mpMRT (sowie u.a. Alter, DRU, freies prostataspezifisches Antigen [fPSA]) zeigte eine „Area under the curve“-Ratio (AUC-Ratio) von 0,876.5 Urinbasierte Biomarker kommen ebenso infrage: Hier zeigte sich mit der Kombination mpMRT und SelectMDx eine AUC-Ratio von 0,84. Die kombinierte Detektionsrate von Prostatakarzinomen bei PIRADS-III-Patienten lag hier bei 58%.6 Die Rolle von Biomarkern bei der Entscheidung bleibt aber bisher ungeklärt und wahrscheinlich nicht kosteneffektiv.
-
Mikroultraschall: Der hochauflösende Mikroultraschall ist ein neuartiges bildgebendes Verfahren mit 29Mhz, das eine Weiterentwicklung des B-Mode Prostata-TRUS darstellt. Einige Arbei-ten zeigen eine zusätzliche Detektionsrate von 11% durch Ergänzung der mpMRT mit dem Mikroultraschall.7
-
PSA-Dichte (PSA-D): wird berechnet, indem der PSA-Wert durch das Prostatavolumen geteilt wird.
-
Größe der suspekten Läsion: Eine ellipsoide Volumenmessung der Läsion in der MRT mit einem Cut-off von 0,5ml kann ohne zusätzliche Untersuchungen oder Kosten durchgeführt werden. In einer Studie zeigte dieses Tool jedoch eine höhere Rate an nicht detektierten Tumoren im Vergleich zur PSA-D (16% vs. 7%).8 Zudem kann die nichtellipsoide Form vieler Läsionen die Reproduzierbarkeit der Volumenmessung verringern.
-
Risikokalkulatoren/Nomogramme: Eine der größten europäischen Studien (European Randomized Study of Screening for Prostate Cancer – ERSPC) brachte einen Kalkulator für biopsienaive Patienten hervor. Das Modell zeigte eine AUC-Ratio von 0,86, wobei hier noch die erste Version der PIRADS-Klassifikation in Verwendung war.9
Unsere Daten
Vor dem Hintergrund dieser Erkenntnisse führten wir eine retrospektive Analyse unserer seit 2019 geführten Prostatabiopsiedatenbank durch. Im Rahmen der Auswertung wurden 353 Patientendaten ausgewertet. In die Studie wurden nur Patienten mit einer PIRADS-III-, -IV- oder -V- Läsion aufgenommen. Die Einstufung jeder Läsion im mpMRT erfolgte nach der zweiten Version der PIRADS-Klassifikation. Das verwendete MRT/US-Fusionsbiopsie-System im Universitätsklinikum St.Pölten ist das BioJet-Programm (Medical Targeting Technologies GmbH) mit einem BK3000-Ultraschallgerät (BK Medical). Der Zugangsweg war am Anfang der Studie überwiegend transrektal, wechselte am Ende des Studienzeitraumes jedoch größtenteils zu transperineal.
Standardmäßig wertete eine einzige erfahrene Uroradiologin alle mpMRTs aus und markierte Konturen der Prostata und der Läsion bzw. der Läsionen in der Biopsie. Nach der Targetbiopsie mit je 3–4 Stanzen pro Läsion (abhängig von der Läsionsgröße) wurden bei allen Patienten noch mindestens 10 systematische Stanzen entnommen. Das Durchschnittsalter lag bei 66,8 Jahren (Interquartilsabstand [IQA]: 61–74) und der mediane PSA bei 9,58ng/ml (IQA: 5,32–11,0ng/ml).
Die Krebsdetektionsrate lag bei 72,24% (entspricht 255/353).
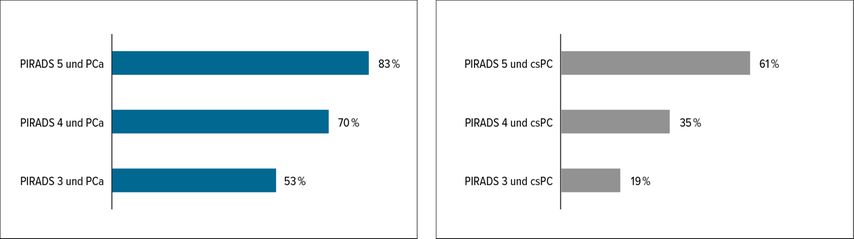
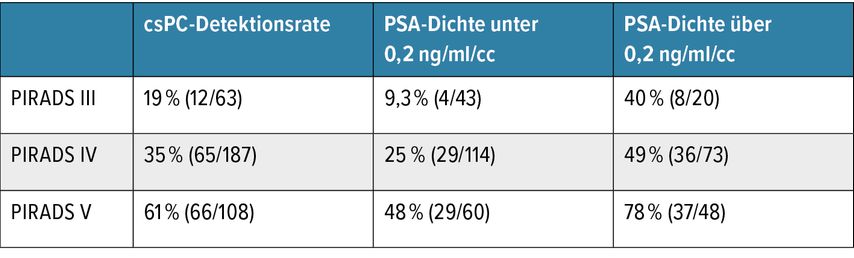
Bei 83% der Patienten (66 von 108 Patienten) in der PIRADS-V-, 70% (130 von 187) in der PIRADS-IV- und 53% (33 von 63) in der PIRADS-III-Graduierungsgruppe konnte ein Karzinom in der Biopsie nachgewiesen werden (Abb. 1). Entsprechend der gängigsten Auslegung definierten wir einen Befund als signifikant (csPC), sobald Grad 2 gemäß der Definition der International Society of Urological Pathology (ISUP) festgestellt wurde. Aufgrund der relativ niedrigen Fallzahlen wurden die PSA-D-Werte in nur 2 Kohorten aufgeteilt: niedrige PSA-D mit ≤0,2ng/ml/cc und hohe PSA-D mit >0,2ng/ml/cc. Von 63 biopsierten Patienten mit PIRADS-III-Befund hatten 12 Patienten ein csPC. Von den Patienten mit niedriger PSA-D hatten nur 9,3% (4 von 43) das Risiko für ein csPC, jedoch 40% (8 von 20) der Patienten mit hoher PSA-D (Tab. 1). In unserer Patientenkohorte hätten, bei 4 nicht diagnostizierten csPC, auf Basis dieser Einstufung 43 Biopsien vermieden werden können. Das entspricht 12% aller durchgeführten Biopsien in der Kohorte. Unsere Analyse ist lediglich als Basis für Hypothesenbildung gedacht, eine prospektive Validierung ist erforderlich.
Abb. 1: Prozentuelle Verteilung der Patienten mit nachgewiesenem Prostatakarzinom (PCa) oder signifikantem Befund (csPC) in denPIRADS-Klassen III–V
Tab. 1: Prozentuelle Verteilung der detektierten csPC-Befunde je nach PIRADS-Klasse mit Kohortenaufteilung mittels PSA-Dichte
Ausblick
Durch die Integration von künstlicher Intelligenz (KI) und den darin inbegriffenen IT-Systematiken wie maschinelles Lernen (ML) könnte die Entscheidungsfindung im diagnostischen Prozess zukünftig optimiert werden. Eine ML-unterstützte Analyse klinischer Risikofaktoren könnte aufzeigen, wie und welche Parameter genutzt und kombiniert werden müssen, um eine optimale Risikobewertung zu erzielen. Es gibt bereits solche Modelle, die bei 72%iger Sensibilität eine Sensitivität von 80% aufweisen.10 In naher Zukunft ist ein explosives Wachstum der Entwicklung und Verwendung von KI-Technologien zu erwarten. Ein anderer Weg könnte die Verbesserung der Qualität der mpMRT-Untersuchungen durch Einführung eines Prostate Imaging Quality Score (PI-QUAL-Score) sein. Der PI-QUAL-Score ist eine Skala von 1 bis 5, wobei ein Score von 1 bedeutet, dass alle MR-Sequenzen (T2-gewichtete Bildgebung, diffusionsgewichtete Bildgebung und dynamische kontrastverstärkte Sequenzen) unter dem Mindeststandard der diagnostischen Qualität liegen. Ein Score von 3 bedeutet, dass der Scan eine ausreichende diagnostische Qualität aufweist, ein Score von 5 hingegen bedeutet, dass alle drei Sequenzen eine optimale diagnostische Qualität haben.11 Bei einem niedrigem PI-QUAL-Score kann es dementsprechend zielführend sein, die Untersuchung zu wiederholen. Das vorgeschlagene Bewertungssystem ist eine Möglichkeit, um die Befundung von Prostata-MRTs weiter zu objektivieren.
Fazit
Die Prostatabiopsie bleibt nach wie vor ein invasiver und unangenehmer Eingriff für Patienten, der zudem das Risiko für Komplikationen, wie Hämaturie und Infektionen, birgt. Bei einem nicht eindeutigen mpMRT-Befund besteht Bedarf an weiterer Stratifizierung: Multivariable Tools zur Risikovorhersage wurden unter Einbeziehung von MRT-Ergebnissen entwickelt, bleiben aber nicht validiert. Statt teure oder schwer zugängliche Tests zu verwenden, empfehlen mehrere Studien die Verwendung der PSA-D als eines unabhängigen Risikofaktors neben dem mpMRT. Ein Grenzwert könnte dabei zwischen 0,1ng/ml/cc und 0,2ng/ml/cc liegen, jedoch müssten eine Standardisierung der Prostatagrößenmessung und auch eine Adjustierung auf Populationsprävalenz erfolgen. Oberstes Ziel des diagnostischen Prozesses ist die gemeinsame Entscheidungsfindung mit dem Patienten mittels „informed consent“, sprich: die offene Aufklärung über mögliche Risiken. Nach entsprechender Risikoabwägung und bei geringem csPC-Risiko kann eine Biopsie letztendlich bei einem Teil der Patienten vermieden werden.
Literatur:
1 Mottet N et al.: EAU-EANM-ESTRO-ESUR-SIOG Guidelines on prostate cancer-2020 update. Part 1: Screening, diagnosis, and local treatment with curative intent. Eur Urol 2021; 79(2): 243-62 2 Drost FJH et al.: Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev 2019; 4(4): CD012663 3 Gosselaar C et al.: The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol 2008; 54(3): 581-8 4 Rodríguez Cabello MA et al.: Diagnostic evaluation and incorporation of PSA density and the prostate imaging and data reporting system (PIRADS) version 2 classification in risk-nomograms for prostate cancer. World J Urol 2022; 40(10): 2439-50 5 Katzendort O et al.: Combination of PI-RADS score and mRNA urine test-A novel scoring system for improved detection of prostate cancer. PLoS 2022; 17(8): e0271981 6 Sun J et al.: A novel nomogram combined PIRADS v2 and neutrophil-to-lymphocyte ratio to predict the risk of clinically significant prostate cancer in men with PSA < 10 ng/ml at first biopsy. Uro Oncol 2020; 38(5): 401-9 7 Rodríguez Socarrás ME et al.: Prostate mapping for cancer diagnosis: The Madrid protocol. Transperineal prostate biopsies using multiparametric magnetic resonance imaging fusion and micro-ultrasound guided biopsies. J Urol 2020; 204(4): 726-33 8 Kortenbach KC et al.: Comparison of PSA density and lesion volume strategies for selecting men with equivocal PI-RADS 3 lesions on bpMRI for biopsies. Abdom Radiol (NY) 2023; 48(2): 688-93 9 Radtke JP et al.: Prediction of significant prostate cancer in biopsy-naïve men: Validation of a novel risk model combining MRI and clinical parameters and comparison to an ERSPC risk calculator and PI-RADS. PLoS One 2019; 14(8): e0221350 10 Aussavavirojekul P et al.: Optimization of clinical risk-factor interpretation and radiological findings with machine learning for PIRADS category 3 patients. Prostate 2022; 82(2): 235-44 11 Giganti F et al.: Understanding PI-QUAL for prostate MRI quality: a practical primer for radiologists. Insights Imaging 2021; 12(1): 59
Das könnte Sie auch interessieren:
AI, EBRT und Co – Zukunft des Stagings beim muskelinvasiven Blasenkarzinom
Im Rahmen des Michael J. Marberger Meetings wurde Zukunftsweisendes zum Einsatz von Artificial Intelligence (AI) beim Blasenkarzinom präsentiert. Es tut sich aber auch einiges abseits ...
mCRPC – State of the Art, und was kommt 2025?
In den letzten Jahren haben sich neben der Chemotherapie mit Docetaxel und Cabazitaxel und den beiden „new hormonal agents“ (NHA) Enzalutamid sowie Abirateron nun die PARP-Inhibitoren ...
Update zum Nierenzellkarzinom vom ASCO GU 2025
Der diesjährige ASCO GU wurde von 14. bis 16.2.2025 in San Francisco abgehalten. Die Veranstaltung hat sich im Laufe vieler Jahre als eine der wichtigsten uroonkologischen Plattformen ...