Gespendete T-Zellen als letzter Ausweg bei viralen Infektionen
Bericht:
Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Adoptive virusspezifische T-Zellen sind eine relativ neue Option in der Behandlung viraler Infektionen, die anders nicht erfolgreich therapierbar sind. Es handelt sich dabei um den autologen oder allogenen Transfer selektierter oder exvivoexpandierter T-Zellen. Typische Einsatzgebiete für diese Zellen sind beispielsweise opportunistische Infektionen bei stark immunsupprimierten Patienten.
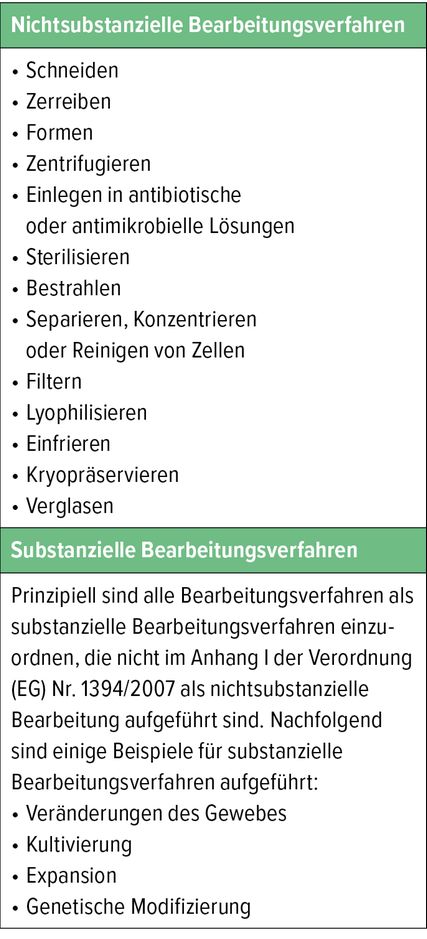
Tab. 1: Substanzielle vs. nichtsubstanzielle Bearbeitungsverfahren gemäß der Verordnung (EG) Nr. 1394/2007 des EU-Parlaments und des Rates (Anhang I)
Bei adoptiven virusspezifischen T-Zellen handelt es sich um ein sogenanntes „advanced therapy medicinal product“ (ATMP), konkret um ein somatisches Zelltherapeutikum. Ein solches besteht laut Paul-Ehrlich-Institut „aus Zellen, die substanziell bearbeitet wurden, sodass biologische Merkmale, physiologische Funktionen oder strukturelle Eigenschaften, die für die beabsichtigte klinische Verwendung relevant sind, verändert wurden. Ihm werden Eigenschaften zur Behandlung, Vorbeugung oder Diagnose von Krankheiten durch pharmakologische, immunologische oder metabolische Wirkungen der enthaltenen Zellen oder Gewebe zugeschrieben und es wird zu diesem Zweck im Menschen verwendet oder ihm verabreicht.“ Als „substanziell“ bezeichnet man alle Verfahren, bei denen Zellen kultiviert oder expandiert werden (Tab. 1), erläuterte Ap. Prof. Priv.-Doz. Dr. Farsad-Alexander Eskandary, PhD, von der Klinischen Abteilung für Nephrologie und Dialyse an der Wiener Universitätsklinik für Innere Medizin III im Rahmen seines Vortrags und wies auf die strengen regulatorischen Vorgaben für diese Verfahren hin. Aktuell können virusspezifische T-Zellen nur in ganz wenigen ausgewählten Labors in Europa hergestellt werden.
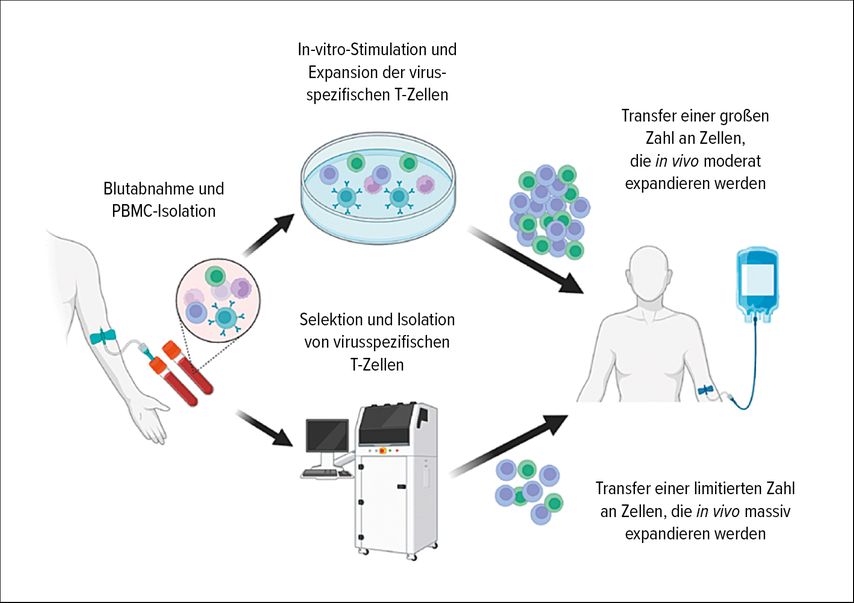
Dabei gibt es grundsätzlich zwei Wege (Abb. 1): die Expansion und die Selektion, wobei die Selektion rechtlich einfacher zu handhaben ist, weil sie streng genommen nicht in den Bereich der ATMP fällt. In beiden Fällen werden zunächst von einem Spender periphere mononukleäre Blutzellen (PBMC) isoliert und anschließend entweder in vitro stimuliert und expandiert, oder es werden aus dem entnommenen Blut virusspezifische Zellen selektiert und isoliert. Mittels Expansion erhält man große Mengen von Zellen, bei denen man davon ausgeht, dass sie prinzipiell nach Re-Infusion in vivo moderat expandieren können. Im Gegensatz dazu gelangt man mit Selektion zu einer relativ kleinen Menge von Zellen, die jedoch in vivo stark expandieren.1
Für beide Verfahren wurden bereits vor 20 Jahren klinische Erfolge berichtet. Mit dem IFN-γ Cytokine Capture System (CCS), das auf der Selektion von IFN-γ-sezernierenden, virusspezifischen T-Zellen beruht, sowie mit „short-term expansion“ (STE), also der Ex-vivo-Expansion von PBMC mittels viraler Peptide, wurden in Fallserien bei Patienten mit Virämie nach hämatopoetischer Stammzelltransplantation eindrucksvolle klinische Resultate erzielt.2
Kooperation mit der Medizinischen Hochschule Hannover
Das AKH Wien bezieht derzeit virusspezifische T-Zellen von der Medizinischen Hochschule Hannover, wo diese im Rahmen eines Programms namens alloCELL nach dem Selektionsverfahren hergestellt werden, so Eskandary. Dort liegt eine Spenderdatenbank mit >500 potenziellen Spendern für virusspezifische T-Zellen für verschiedene relevante Viren vor (CMV, ADV, BKV, EBV,...), aus der ein immunologisch möglichst kompatibler Spender (guter HLA-Match) zur Zellspende zeitnahe ausgesucht werden kann und dann gegebenfalls einberufen wird. Eskandary: „Man weiß von diesen Zellen, welchen HLA-Typ sie haben und gegen welche Viren sie einsetzbar sind.“ Das in Hannover eingesetzte CliniMACS Prodigy System ist mittlerweile auch im AKH verfügbar und kommt hier derzeit beispielsweise für die Produktion von CAR-T-Zellen zum Einsatz. Das System stimuliert T-Zellen dahingehend, dass sie IFN-γ sezernieren, markiert diese Zellen mit magnetisch gekoppelten Antikörpern und kann sie auf diesem Wege selektieren und als Zellprodukt ernten.
Bis vor Kurzem wurden am Children‘s Cancer Research Institute (CCRI) des St. Anna Kinderspitals, Wien(ehemals Arbeitsgruppe von Priv.-Doz. Dr. René Geyeregger), virusspezifische T-Zellen nach einem auf Ex-vivo-Expansion beruhenden Verfahren hergestellt. Eskandary: „Leider wurde dieses Programm im vergangenen Jahr aus unterschiedlichen Gründen eingestellt und steht uns nicht mehr zur Verfügung. Einige Patienten konnten wir jedoch behandeln. Aktuell forcieren wir die Kooperation mit Hannover, bis wir diese Technologie ins AKH übersiedeln können.“
Herstellungsverfahren im Vergleich
Beide Verfahren haben Vor- und Nachteile. So werden mit dem Expansionsprotokoll große Mengen an Zellen produziert. Eskandary schildert einen Beispielfall, in dem aus dem Apheresat einer einzelnen Zellentnahme elf Portionen für Patientenbehandlungen mit allogenen virusspezifischen T-Zellen gewonnen wurden. Allerdings haben Expansionsprotokolle den Nachteil des Zeitverlustes, weil die Expansion ex vivo plus Weiterverarbeitung des Zellprodukts rund zwei Wochen in Anspruch nimmt. Mittels Selektionsprotokoll steht hingegen ein T-Zell-Produkt potenziell innerhalb von 48 Stunden zur Verfügung. Darüber hinaus unterscheiden sich die beiden Verfahren hinsichtlich der Reinheit der gewonnenen Produkte. Während das Expansionsverfahren ein Gemisch unterschiedlicher T-Zell- und anderer Immunzellpopulationen (z.B. CD8+-Zellen, CD4+-Zellen, CD19+-B-Zellen, NK-Zellen) enthält, gelangt man mit dem Selektionsprotokoll zu sehr reinen Präparaten der gewünschten T-Zell-Population.3
Virusspezifische T-Zellen auf dem Weg in die klinische Routine
Evidenz für die klinischen Wirksamkeit transferierter T-Zellen gibt es seit vielen Jahren. So zeigte eine der Landmark-Studien auf diesem Gebiet bereits 1995, dass eine rasche Rekonstitution zellulärer Immunität gegen das Zytomegalievirus bei Patienten nach allogener Stammzelltransplantation erreicht werden kann, wenn zusätzlich T-Zell-Klone des Spenders transferiert werden.
Mögliche Indikationen für eine Behandlung mit virusspezifischen T-Zellen sind opportunistische virale Infektionen, bei denen die gewohnten Therapieoptionen häufig an ihre Grenzen stoßen bzw. bei denen keine spezifischen antiviralen Therapien verfügbar sind. Das betrifft beispielsweise das BK-Virus, das JC-Virus, das Epstein-Barr-Virus oder Adenoviren. Ebenso können virusspezifische T-Zellen bei therapierefraktären Infektionen versucht werden. Eskandary nannte als Beispiel einen mit Zytomegalievirus infizierten Patienten, bei dem mit Valganciclovir, Ganciclovir, Maribavir und Foscarnet kein Therapieerfolg erzielt werden konnte.
Ein weiteres potenzielles Einsatzgebiet besteht bei immunkompromittierten Patienten, bei denen eine rasche Immunrekonstitution nicht wahrscheinlich ist. Auch angeborene Immundefizienzen kommen infrage, so Eskandary. Ist es bei einem immunsupprimierten Patienten nicht möglich, die Immunsuppression schnell genug zu reduzieren, um antivirale Kontrolle zu erlangen, kann dies ebenfalls eine Indikation für den Einsatz virusspezifischer T-Zellen sein.
Gerade für Patienten, bei denen es zeitkritisch ist, stellen „off the shelf“ virusspezifische T-Zellen (VST) aus Zellbanken eine gute Option dar. In den USA bestehen bereits mehrere Banken, aus denen innerhalb eines Tages T-Zellen für viele Einsatzbereiche verfügbar sind. Der Einsatz dieser „3rd-party banked VST“ gegen opportunistische Infektionen wurde bereits in einer Reihe von Studien dokumentiert.4 Der Einsatz virusspezifischer T-Zellen kann jedoch in schwierigen klinischen Situationen auch eine Option gegen häufige Viren wie Influenza A oder Noroviren sein, auch wenn dazu bislang die klinischen Studien fehlen.5 Eskandary wies nicht zuletzt auch auf die Möglichkeit hin, spezifische T-Zellen gegen Pilzinfektionen herzustellen. Die erfolgreiche Produktion solcher Zellen für den Einsatz gegen Infektionen mit Aspergillus fumigatus im Gefolge einer allogenen hämatopoetischen Stammzelltransplantation (HSCT) wurde vergangenes Jahr unter Mitwirkung des St. Anna Kinderspitalspubliziert.6
Virusspezifische T-Zellen als neue Hoffnung bei PML
Eine wichtige Indikation für virusspezifische T-Zellen stellt mittlerweile die Behandlung der progressiven multifokalen Leukenzephalopathie (PML) dar. Dabei handelt es sich um eine lebensbedrohende demyelinisierende Erkrankung des Gehirns, die durch eine Reaktivierung einer latenten Infektion mit dem JC-Virus (humanes Polyomavirus 2) verursacht wird. Das JC-Virus ist bei 60–90% der erwachsenen Bevölkerung nachweisbar und beim Gesunden durch das Immunsystem gut kontrolliert. Unter Immunsuppression kann es zur Reaktivierung kommen, wobei das Virus zusätzlich einen Tropismus zum zentralen Nervensystem entwickelt. Die Folge ist die PML, die anhand von Klinik, MRT sowie durch den Virusnachweis aus dem Liquor diagnostiziert wird. Die Prognose hängt von der Grundkrankheit bzw. der Art der Immunsuppression ab. Rund 50% der PML-Fälle stehen in Zusammenhang mit HIV-Infektionen, PML tritt aber auch nach Organtransplantationen oder z.B. unter immunsuppressiven Therapien der Multiplen Sklerose auf. Es gibt keine zugelassene Therapie. Da JC- und BK-Viren gemeinsame immunogene Epitope aufweisen, ist der Einsatz von BK-Virus-spezifischen T-Zellen bei PML eine Option.
Mittlerweile zeigen mehrere Publikationen gutes Ansprechen bei einem relativ hohen Anteil der Patienten. Eskandary berichtete auch von vielversprechenden Erfolgen in Wien, wo mittlerweile durch interdisziplinäre Zusammenarbeit mit dem CCRI (Geyeregger), der Neurologie (Assoc. Prof. Dr. Paulus Rommer), der Transfusionsmedizin (Univ.-Prof. Dr. Nina Worel) und der Nephrologie (Eskandary) vier PML-Patienten behandelt wurden. Die bislang größte Studie zum Einsatz virusspezifischer T-Zellen bei PML zeigt allerdings, dass der wichtigste Prognosefaktor die Viruslast vor Therapiebeginn ist. Auch der Zeitfaktor ist essenziell. In der Studie starben sechs Patienten, bevor ihre T-Zellen fertig für den Transfer waren.7 Zellbanken bieten sich also auch in dieser Indikation als Quelle für das T-Zell-Produkt an.
Eine weitere Indikation für virusspezifische T-Zellen stellen EBV-positive Posttransplantationslymphome dar. Entsprechende Studien wurden unter Mitwirkung des Wiener AKH durchgeführt und resultierten in der Zulassung eines entsprechenden Produkts durch die EMA.8
Quelle:
„Therapie mit adoptiven Virus-spezifischen T-Zellen“; Vortrag von Ap. Prof. Priv.-Doz. Dr. Farsad-Alexander Eskandary, PhD, Wien, im Rahmen des ÖIK am 12. April 2024 in Saalfelden
Literatur:
1 Lambert N et al.: Viruses 2023; 15(7): 1510 2 Moss P, Alan Rickinson A: Nat Rev Immunol 2005; 5(1): 9-20 3 Heinz AT et al.: Haematologica 2023; 108(8): 2080-90 4 Quach DH et al.: Blood 2023; 141(8): 877-85 5 Keller MD, Bollard CM: Blood 2020; 135(9): 620-8 6 Tischer-Zimmermann S et al.: Front Immunol 2023; 14: 988947 7 Cortese I et al.: Lancet Neurol 2021; 20(8): 639-5 28 https://ec.europa.eu/health/documents/community-register/2022/20221216157616/anx_157616_de.pdf ; zuletzt aufgerufen am 26.7.2024
Weitere Literatur:
beim Vortragenden
Das könnte Sie auch interessieren:
Lokale Antibiotikatherapie: einige Indikationen mit guter Evidenz
Eine Lokaltherapie mit einem Antibiotikum ist nicht nur an der Haut möglich, sondern kann beispielsweise im Respirationstrakt mittels Inhalation erfolgen. Allerdings besteht bei Weitem ...
Phytotherapie bei Infektionen der Blase und der Atemwege
Heilpflanzen finden seit den frühen Tagen der Menschheit Anwendung bei unterschiedlichsten Erkrankungen. Aktuell besteht das Bemühen, die empirische Anwendung mit Evidenz aus klinischen ...
Hat der Pap-Test in Zeiten der HPV-Impfung noch Zukunft?
Die Inzidenz von Zervixkarzinomen infolge von HPV-Infektionen konnte durch zytologisches Screening in etwa halbiert werden. Mit Einführung der HPV-Impfung besteht nun die Möglichkeit, ...