CROI 2024: „Long-acting“-Konzepte im Fokus der Forschung
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bereits zum 31. Mal fand mit der Conference on Retroviruses and Opportunistic Infections eine der wichtigsten Konferenzen im HIV-Bereich statt. Von 3. bis 6.März 2024 kamen ca. 4000 Expert:innen im US-amerikanischen Denver zusammen und diskutierten aktuelle Themen.
Wie jedes Jahr wurde die CROI nicht nur ihrem hohen wissenschaftlichen Anspruch gerecht, sondern spiegelte mit der Auswahl der Inhalte auch aktuelle Themenschwerpunkte wider. Anschaulich zeigt sich dies bei den Abstracts: Von 1067 angenommenen Abstracts (56% aller eingereichten) befassten sich 784 dezidiert mit Bevölkerungsgruppen, die besonderen Herausforderungen gegenüberstehen. Hier gab es eine Verschiebung der Prioritäten im Vergleich zur CROI 2023: So beschäftigten sich mit 259 Abstracts knapp 100 Arbeiten mehr mit Frauen und Mädchen als noch im Vorjahr. Die Anzahl der Abstracts zu Jugendlichen stieg von 76 auf 137 an und die zu Transmenschen von 55 auf 84. Unabhängig von Zusammenhängen mit bestimmten Kohorten oder Personengruppen, bot die Konferenz inhaltlich eine hohe Diversität an Themen.
Im Bereich HIV lag ein Fokus auf Ansätzen mit langanhaltender Wirkung. Die Erforschung und die Entwicklung neuer Substanzen, Formulierungen und Kombinationen sind essenziell, um Möglichkeiten und Erfolge der HIV-Therapie auszubauen. Die „Long-acting“-Konzepte können supportiven Einfluss auf die Adhärenz und damit den klinischen Therapieerfolg haben und somit den Alltag von Menschen mit HIV erleichtern.
Lenacapavir und Islatravir: Daten zu oraler Therapie einmal die Woche
Ein aktueller Ansatz ist die Dualtherapie mit Lenacapavir (LEN) und Islatravir (ISL) als orale Einnahme 1-mal pro Woche. LEN ist ein bereits zugelassener Kapsid-Inhibitor und ISL ein neuartiger nukleosidischer Reverse-Transkriptase-Translokations-Inhibitor (NRTTI). Diese Substanzkombination zeichnet sich dadurch aus, dass sie im viralen Replikationszyklus an mehreren Stellen ansetzt, bereits in geringer Dosierung hohe antivirale Aktivität zeigt und infolge langer Halbwertszeiten eine wöchentliche Dosierung ermöglicht.
Auf der CROI wurden nun 24-Wochen-Daten einer Phase-II-Studie mit ISL/LEN präsentiert.1 Eingeschlossen waren 104 Personen unter Therapie mit B/F/TAF (Bictegravir/Emtricitabin/Tenofoviralafenamid), die eine Viruslast (VL) unter 50 Kopien/ml sowie eine CD4-Zellzahl über 350/µl aufwiesen. Nachgewiesene Hepatitis B sowie Gesamtlymphozytenzahl unter 900/µl waren Ausschlussgründe. Im Durchschnitt lag die Zahl der CD4-Zellen bei 786/µl und die der Lymphozyten bei 1940/µl. Das Durchschnittsalter der Teilnehmenden lag bei 40 Jahren, 18% waren Frauen, 50% nicht kaukasisch. Die Teilnehmer:innen wurden 1:1 in die beiden Studienarme mit B/F/TAF oder ISL/LEN randomisiert.
Bei der Zwischenauswertung nach 24 Wochen hatten in beiden Studienarmen 94,2% (je 49 von 52) eine supprimierte VL mit >50/ml. Fünf Personen hatten die Studie aus nichttherapieassoziierten Gründen abgebrochen. Eine Person unter ISL/LEN hatte zum Auswertungszeitpunkt eine nachweisbare VL mit 64/ml, welche zu Woche 30 wieder unter der Nachweisgrenze lag. Es wurden keine substanzabhängigen Resistenzen registriert. Sowohl die CD4-Zellzahl als auch die Lymphozytenzahl blieb in beiden Armen stabil.1
Diese ersten Daten zeigen, dass die Kombination ISL/LEN das Potenzial hat, das erste orale HIV-Therapieregime mit wöchentlicher Einnahme zu werden.
MK-8527: ein NRTTI-Kandidat mit Dosierung einmal wöchentlich
Als neue Substanz mit einer möglichen Wochendosierung wurde ein Wirkstoff mit dem Kürzel MK-8527 präsentiert.2 Es handelt sich wie bei Islatravir um einen NRTTI.
Die pharmakokinetischen Daten unterstützen ein Dosierungsintervall von einmal die Woche bis zu einmal im Monat. Präklinische Daten lassen vermuten, dass MK-8527 keinen Einfluss auf das Cytochrom-P450-System hat und somit ein geringes Interaktionspotenzial aufweisen dürfte. In zwei Phase-I-Studien wurden die antiretrovirale Aktivität von MK-8527, das pharmakokinetische Profil sowie Sicherheit und Verträglichkeit untersucht. 37 therapienaive Teilnehmer:innen mit HIV erhielten eine einmalige orale Gabe von MK-8527.
Mit geringen Dosierungen von 0,5mg konnte die angestrebte Reduktion der Viruslast von über 1xlog10Kopien/ml innerhalb von 7 Tagen erreicht werden. ImAllgemeinen wurde der Wirkstoff gut vertragen, es gab keine substanzassoziierten unerwünschten Nebenwirkungen, keine Veränderungen in diversen Vitalparametern und keine klinisch relevanten Vorkommnisse. Die pharmakokinetische Dynamik war mit der Kontrollgruppe der Menschen ohne HIV vergleichbar. Diese Ergebnisse in Kombination mit anderen Daten von MK-8527 sprechen für die Fortsetzung der klinischen Studien und damit für eine weitere potenzielle „Long-acting“-Substanz in der HIV-Therapie der Zukunft.
GS-1720: ein möglicher INSTI mit Dosierungeinmal wöchentlich
In der Substanzklasse der Integrase-Strangtransfer-Inhibitoren (INSTI) steht unter dem Kürzel GS-1720 ebenfalls ein neuer Wirkstoff in Erforschung, welcher sich zur wöchentlichen oralen Dosierung eignen kann. Vorgestellt wurden Daten zu antiviraler Aktivität, Sicherheit und Pharmakokinetik von GS-1720 aus zwei Phase-I-Studien.3
PhaseIa inkludierte Teilnehmer:innen ohne HIV, die GS-1720 entweder als einmalige Gabe oder in mehrfacher Gabe in einer Dosierung von 50 bis 1350mg erhielten. Die mediane Halbwertszeit bei einer Einzeldosis von 450mg lag bei 9,4 Tagen. Die darauf aufbauende Phase-Ib-Studie inkludierte 28 Personen mit HIV mit einer VL zwischen 5000 und 400000 Kopien/ml und CD4-Zellwerten über 200/µl. Die Teilnehmer:innen waren alle entweder therapienaiv, hatten bislang keine HIV-Therapie mit einem INSTI erhalten oder hatten in den letzten 12 Wochen keine Therapie eingenommen. Die Gabe von GS-1720 erfolgte in 4 Gruppen mit unterschiedlichen Dosierungen.
Die Reduktion der Viruslast an Tag 11 nach Einnahme von GS-1720 an Tag 1 und 2 lag in der Gruppe mit 150mg bei 2,18xlog10 und in der Gruppe mit 450mg bei 2,44xlog10. In beiden Kohorten wurde keine therapieassoziierte INSTI-Resistenz detektiert. Bei keiner/keinem der Teilnehmer:innen traten schwerwiegende unerwünschte Ereignisse oder substanzassoziierte Nebenwirkungen auf.3 Die Studie unterstützt damit eine Weiterführung der Entwicklung von GS-1720 als erstem INSTI mit wöchentlicher Dosierung und damit eine mögliche Erweiterung des Therapie-Portfolios der „Long-acting“-Wirkstoffe.
Cabotegravir: 4-monatliches Dosierungsintervall in Sicht
Lange Dosierungsintervalle mithilfe von „Long-acting“-Substanzen können für Patient:innen unter HIV-Therapie einen enormen Unterschied im Lebensalltag bewirken und damit die nachhaltige virale Suppression fördern. Eine Präsentation im Rahmen der CROI befasste sich mit der Ausweitung des Dosierungsintervalls von Cabotegravir (CAB).4
Derzeit ist der Integrase-Inhibitor (in Kombination mit Rilpivirin) als HIV-Therapie zur Injektion alle vier oder acht Wochen zugelassen. Um eine Administration in längeren Abständen zu ermöglichen, wurden Pharmakokinetik und Sicherheit von zwei Strategien untersucht: einerseits die Erhöhung des Injektionsvolumens und damit der Dosis der aktuellen CAB-Formulierung (CAB200) durch die Kombination mit rekombinanter humaner Hyaluronidase PH20 (rHuPH20), andererseits der Einsatz einer neuen „Ultra-long-acting“-Formulierung von Cabotegravir (CAB-ULA).
Für die erste Strategie inkludierte die Studie 22 Teilnehmer:innen ohne HIV zur einmaligen subkutanen Injektion von CAB200+rHuPh20 in unterschiedlichen Mengen von 4 bis 16ml. Nach Auswertung der ersten Ergebnisse hinsichtlich Pharmakokinetik und Verträglichkeit wurde diese Strategie eingestellt.
Zur Evaluierung der zweiten Strategie erhielten 48 Personen ohne HIV die neue Formulierung CAB-ULA als einmalige subkutane oder intramuskuläre Injektion in mehreren Dosierungen (800mg bis 1600mg in 2 bzw. 3ml). Die pharmakokinetischen Profile von CAB-ULA zeigten eine langsamere Absorption und ermöglichten eine Abschätzung der Halbwertszeit. Subkutan appliziertes CAB-ULA hat vermutlich eine 6-mal längere und intramuskulär appliziertes CAB-ULA vermutlich eine 2-mal längere Halbwertszeit im Vergleich zum aktuell verwendeten i.m. injizierten CAB200. Die i.m.Applikation wurde insgesamt besser vertragen als die s.c.Injektion, auftretende Nebenwirkungen an der Injektionsstelle waren vergleichbar.
Die neue CAB-ULA-Formulierung zur i.m.Injektion mit gutem Verträglichkeits- und Sicherheitsprofil ermöglicht laut den vorliegenden Daten ein Dosierungsintervall von vier Monaten (Q4M). Damit könnte CAB-ULA-Q4M die HIV-Therapie sowohl im klinischen Setting als auch im Lebensalltag der Patient:innen deutlich vereinfachen.
Cabotegravir und Rilpivirin: Monatliche Injektion bietet Vorteile
Trotz immer besserer Verfügbarkeit, günstigerer Nebenwirkungsprofile und größerer Effektivität der Therapieregime als täglich eingenommene Tablette gelingt es nicht bei allen Patient:innen mit HIV, die Viruslast nachhaltig unter die Nachweisgrenze zu drücken. Den Autor:innen der LATITUDE-Studie zufolge erreichen in den USA nur 56% der Menschen unter Therapie eine VL <50/ml.5 Ursächlich sind häufig Faktoren wie Wohnungslosigkeit oder psychologische Problematiken. Bei diesen Personen könnten langwirksame injizierbare Therapien eine Alternative bieten. Allerdings waren in bisherigen Studien zur einzigen zugelassenen injizierbaren Therapie mit Cabotegravir/Rilpivirin (CAB/RPV-LA) Menschen mit virologischem Versagen oder möglichen Adhärenzproblematiken in der Anamnese ausgeschlossen.
Die präsentierte LATITUDE-Studie inkludierte daher Menschen mit bestehender Virämie trotz Therapieverschreibung oder mit „lost to follow-up“ und Nichtadhärenz über sechs Monate.5 Ausschlussgründe waren eine Hepatitis B oder nachgewiesene Resistenzen gegen Integrase-Inhibitoren und RPV. Keine Ausschlussgründe hingegen waren CD4-Zellzahl, VL >50Kopien/ml, Substanz- und Alkoholkonsum oder unstabile Wohnverhältnisse. Bei den Teilnehmenden wurde zunächst innerhalb weniger Wochen mittels oraler Therapie die Viruslast unter die Nachweisgrenze gesenkt. Anschließend wurden sie randomisiert auf CAB/RPV-LA (i.m.Injektion 1x pro Monat) umgestellt oder verblieben auf der oralen Standardtherapie. Das mediane Alter der 434 Personen lag bei 40 Jahren (20% unter 20 Jahren, 53% zwischen 31 und 50 Jahren), 64% waren Afroamerikaner:innen, der Frauenanteil lag bei 30% und 5% identifizierten sich als transident.
Die Kohorte zeigte die Herausforderungen auf: 14% berichteten von aktuellem oder früherem intravenösem Substanzkonsum, 20% hatten ein „lost to follow-up“, 65% ein unzureichendes virologisches Ansprechen, auf 15% traf beides zu. 68% hatten bei Einschluss eine VL >200/ml, davon 14% über 100000/ml. Der mediane CD4-Zellwert lag bei 270/µl. Trotz potenzieller Schwierigkeiten im Lebensalltag mit der Therapie erfolgten im CAB/RPV-LA-Arm 93% aller Injektionen zeitgerecht. 4% erfolgten zu früh oder zu spät und nur 3% wurden ausgelassen.
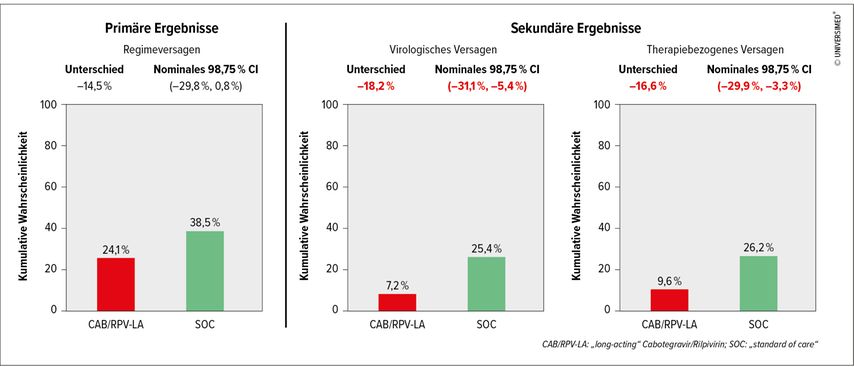
48Wochen nach Randomisierung wurde die kumulative Wahrscheinlichkeit eines Regimeversagens (Kombination aus Therapieabbruch und virologischem Versagen) – dem primären Endpunkt – verglichen (Abb. 1): In der CAB/RPV-LA-Gruppe lag die Wahrscheinlichkeit bei 24,1%, in der Gruppe mit oraler Standardtherapie mit 38,5% deutlich höher, obwohl der primäre Endpunkt das vordefinierte Abbruchkriterium für diese Zwischenanalyse (nominales 98,75%-Konfidenzintervall ohne Null) nicht erfüllte. Die wichtigsten sekundären Endpunkte erfüllten jedoch dieses strenge Kriterium: Die Wahrscheinlichkeit für ein virologisches Versagen lag bei CAB/RPV-LA bei 7,2% und im Vergleichsarm bei 25,4%, die Wahrscheinlichkeit für therapiebezogenes Versagen (Kombination aus virologischem Versagen und Therapieabbruch aufgrund von unerwünschten Ereignissen) bei 9,6% bzw. 26,2%. Auf Basis dieser Daten wurde kurz vor der CROI 2024 die Studie abgebrochen und allen infrage kommenden Teilnehmer:innen die Injektionstherapie angeboten, die in diesem Setting überlegen war.5
Die Studie zeigt auf, dass Menschen mit großen Herausforderungen von CAB/RPV-LA profitieren können und für diese Kohorte bessere Optionen zum Erreichen einer supprimierten Virämie möglich sind.
Triple-bNAb-Kombination: Monatliche Infusion zeigt Potenzial
HIV-spezifische breitneutralisierende Antikörper (bNAb) stehen schon lange im Fokus der Erforschung neuer Konzepte gegen HIV. Sie besitzen das Potenzial einer nachhaltigen Suppression der Virämie. Beim Einsatz von Mono- und Dual-bNAb-Kombinationen wurden jedoch bislang eine schnelle Selektion von resistenten HI-Viren und damit nur sehr limitierte therapeutische Effekte beobachtet.
Die auf der CROI vorgestellte T003-Studie setzte eine Dreifachkombination von bNAb ein (PGT121, PGDM1400 und VRC07-523LS), welche jeweils unterschiedliche Epitope binden.6 Eingeschlossen waren 12 Personen, deren Viruslast durch die HIV-Therapie <50 Kopien/ml lag. Nach der ersten Gabe der Triple-bNAb-Kombination wurde die antiretrovirale Therapie eingestellt. Es folgten bis zu insgesamt sechs bNAb-Infusionen im monatlichen Abstand. Allgemein wurde die Antikörperkombination gut vertragen, sowohl von den Teilnehmer:innen mit HIV als auch von der Kontrollgruppe mit Personen ohne HIV. Die Halbwertszeiten der bNAb lagen wie erwartet zwischen 19,9 und 44,9 Tagen (je nach Antikörper) und die mehrmalige Infusion verursachte keine Veränderung des pharmakokinetischen Profils.
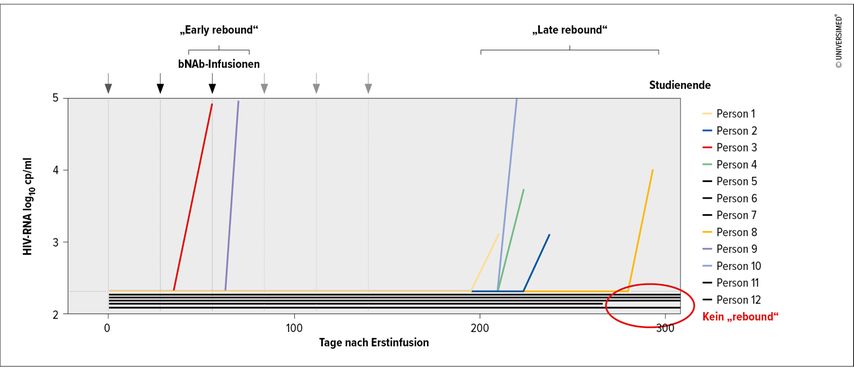
Es zeigten sich drei unterschiedliche Muster im potenziellen Anstieg der Viruslast („viral rebound“; Abb. 2): Bei zwei Teilnehmer:innen kam es zu einem „early rebound“ innerhalb der ersten 12 Wochen. Sequenzierungen ergaben bestehende Resistenzen gegen zwei der bNAb. Fünf Personen blieben nach der letzten bNAb-Gabe virologisch supprimiert und hatten einen sogenannten „late rebound“ nach 28 Wochen und später. Hier stand der „rebound“ sowohl mit sinkenden Plasmaspiegeln als auch mit einer Mischung von resistenten und sensiblen Viren in Zusammenhang. Als drittes Muster gab es vier (eventuell fünf, jedoch eine „lost to follow-up“) Personen, bei denen die bNAb-Konzentrationen ebenfalls auf niedrige oder nicht nachweisbare Werte sanken. Allerdings kam es während des gesamten Beobachtungszeitraumes von mindestens 44 Wochen zu keinem viralen „rebound“.6
Abb. 2: Antivirale Aktivität von multiplen Dosen der Triple-bNAb-Kombination (modifiziert nach Juelg BD 2024)6
Die Studie zeigt trotz der geringen Fallzahl und kurzen Beobachtungszeit das grundsätzliche Potenzial dieser Triple-bNAb-Kombination, bei Patient:innen ohne HIV-Therapie eine anhaltende Virussuppression zu bewirken.
CROI – durchgehender Fokus auf die Menschen
Noch deutlicher als im Vorjahr gab die CROI klare Vorgaben zu gewünschten sprachlichen Formulierungen, wie folgende Ausschnitte aus dem Kongressprogramm aufzeigen: Sprechen Sie von „Menschen mit HIV“ und nicht von „HIV-infizierten Menschen“. Bezeichnen Sie Personen, die an Studien teilnehmen, nicht als „Patient:innen“, sondern als „Teilnehmer:innen“. Achten Sie auf die korrekte Verwendung geschlechtsbeschreibender Begriffe, geeignet sind Ergänzungen mit „cisgender und trans*gender“. Verwenden Sie in Zusammenhang mit HIV-Heilung nicht den Begriff „sterilisieren“, da er aufgrund historischer Sterilisationskampagnen oft negativwahrgenommen wird.
Damit fokussiert die CROI trotz ihrer klaren wissenschaftlichen Ausrichtung auch auf emotionale Bedürfnisse der Menschen und bleibt auch auf dieser Ebene ihrem Image als führende Konferenz im HIV-Bereich treu.
Literatur:
1 Colson A: Efficacy and safety of weekly islatravir plus lenacapavir in PWH at 24 weeks: a phase II study. CROI 2024; Oral Session-14 (Abstract 208) 2 Carstens RP: Single dose administration of MK-8527, a novel nRTTI, in adults with HIV-1. CROI 2024; Oral Session-03 (Abstract 115) 3 Fichtenbaum CJ: Antiviral activity, safety, and pharmacokinetics of GS-1720: a novel weekly oral InSTI. CROI 2024; Oral Session-03 (Abstract 116) 4 Han K et al.: Phase I study of cabotegravir long-acting injectable formulations supports ≥4-monthly dose interval. CROI 2024; Oral Session-04 (Abstract 130) 5 Rana AI: Long-acting injectable CAB/RPV is superior to oral ART in PWH with adherence challenges: ACTG A5359. CROI 2024; Oral Session-14 (Abstract 212) 6 Juelg BD: Therapeutic efficacy of a triple combination of HIV-1 broadly neutralizing antibodies. CROI 2024; Oral Session-03 (Abstract 121)
Das könnte Sie auch interessieren:
Lokale Antibiotikatherapie: einige Indikationen mit guter Evidenz
Eine Lokaltherapie mit einem Antibiotikum ist nicht nur an der Haut möglich, sondern kann beispielsweise im Respirationstrakt mittels Inhalation erfolgen. Allerdings besteht bei Weitem ...
Phytotherapie bei Infektionen der Blase und der Atemwege
Heilpflanzen finden seit den frühen Tagen der Menschheit Anwendung bei unterschiedlichsten Erkrankungen. Aktuell besteht das Bemühen, die empirische Anwendung mit Evidenz aus klinischen ...
Hat der Pap-Test in Zeiten der HPV-Impfung noch Zukunft?
Die Inzidenz von Zervixkarzinomen infolge von HPV-Infektionen konnte durch zytologisches Screening in etwa halbiert werden. Mit Einführung der HPV-Impfung besteht nun die Möglichkeit, ...