Kurative Chirurgie des nichtkleinzelligen Lungenkarzinoms
Autor:
Assoz. Prof. Priv.-Doz. Dr. Jörg Lindenmann
Klinische Abteilung für Thorax- u. Hyperbare Chirurgie
Universitätsklinik für Chirurgie
Medizinische Universität Graz
E-Mail: jo.lindenmann@medunigraz.at
Die Behandlung von Patient:innen mit einem nichtkleinzelligen Lungenkarzinom (NSCLC) hat innerhalb der letzten zwei Jahrzehnte aufgrund von neuen, komplexen und individualisierten Therapiekonzepten eine professionelle Multidisziplinarität erfahren. Gleichzeitig hat in diesem Zusammenhang auch die Thoraxchirurgie mit ihren unterschiedlichen Resektionstechniken zunehmend an therapeutischer Bedeutung gewonnen. Durch die konsequente Weiterentwicklung thoraxchirurgischer Zugänge und Techniken stellt der thoraxchirurgische Eingriff beim operablen Lungenkarzinom nach wie vor den zentralen Bestandteil im individualisierten multimodalen Therapiekonzept dar.1
Keypoints
-
Die chirurgische Resektion stellt nach wie vor den zentralen Bestandteil in der multimodalen Therapie des operablen nichtkleinzelligen Lungenkarzinoms dar.
-
Die Frühstadien des nichtkleinzelligen Lungenkarzinoms bzw. jene Patient:innen mit einer für Lobektomie unzureichenden kardiopulmonalen Reserve profitieren von der Lungenparenchym-schonenden anatomischen Segmentresektion, die gegenüber der herkömmlichen Lobektomie onkochirurgisch vergleichbare Ergebnisse aufweist.
-
Die chirurgische Resektion nach vorangegangener Induktionstherapie kann aufgrund der mitunter ausgeprägten peribronchialen bzw. perivaskulären Verwachsungen eine chirurgische Herausforderung darstellen, die a priori in der präoperativen Operationsplanung berücksichtigt werden muss.
-
Diese Form der Chirurgie sollte daher immer in einem Zentrum mit hoher thoraxchirurgischer Expertise, interdisziplinärer Kooperation und entsprechendem Komplikationsmanagement durchgeführt werden.
Allgemeine thoraxchirurgische Aspekte
Im Falle des NSCLC bietet die thoraxchirurgische Resektion heute zunehmend auch bei funktionell eingeschränkten und älteren Patient:innen sowie bei (lokal) fortgeschrittenen Tumorstadien die Möglichkeit eines kurativen therapeutischen Ansatzes. In diesem Zusammenhang ist es durch die Perfektionierung Lungenparenchym-sparenderResektionstechniken in Kombination mit broncho-bzw. angioplastischer Resektion gelungen, die Rate an bis dato unvermeidbaren Pneumonektomien signifikant zu reduzieren.
Gleichzeitig kann damit dem stetig wachsenden Anteil von älter werdenden Patient:innen mit Lungenkarzinom mit erhöhter kardiopulmonaler Komorbidität und verminderter respiratorischer Reserve eine adäquate chirurgische Therapie unter kurativer Zielsetzung angeboten werden. Dies ist nicht zuletzt auch der steten Weiterentwicklung der minimalinvasiven Resektionstechniken geschuldet, von der videoassistierten Thoraxchirurgie (VATS) bis hin zur roboterassistierten Thoraxchirurgie (RATS), die mit einem deutlich geringeren Operationstrauma verbunden sind.
Wie eingangs schon erwähnt, stellt die chirurgische Resektion des operablen Lungenkarzinoms die Therapie der Wahl dar. Bedauerlicherweise sind zum Zeitpunkt der Diagnosestellung nach wie vor nur ca. 25–30% der Patient:innen unter kurativer Zielsetzung operabel. Beschränkt sich das Karzinom auf einen Lungenlappen, so ist – unabhängig, ob in klassisch „offener“ Technik oder über minimalinvasiven Zugang – die Lobektomie als Resektionsform nach wie vor der onkochirurgische Goldstandard.2
Je nach Tumorstadium bzw. Tumorgröße und Lokalisation kann auch eine broncho- bzw. angioplastische Resektion, eine Bilobektomie oder eine Pneumonektomie indiziert sein. Im Falle von lokal fortgeschrittenem Tumorwachstum ist eine erweiterte Resektion der infiltrierten Strukturen und Organe unvermeidbar, um die angestrebte R0-Resektion sicherstellen zu können. In diesem Zusammenhang ist die chirurgische En-bloc-Resektion von großer Bedeutung, da ein intraoperatives Streuen von Tumorzellen in jedem Fall vermieden werden muss.
Lymphknotendissektion
Unabhängig von der chirurgischen Resektionstechnik bzw. vom erforderlichen Resektionsausmaß stellt die intraoperative Lymphknotendissektion einen unverzichtbaren Bestandteil in der Chirurgie des NSCLC mit kurativer Zielsetzung dar. Das ideale Ausmaß der intraoperativen mediastinalen Lymphadenektomie ist noch immer Gegenstand teils kontroverser Diskussion. Ein diesbezüglicher „Goldstandard“ konnte bis jetzt noch nicht etabliert werden. Die Bandbreite der Lymphadenektomie beim NSCLC reicht von selektiver Lymphknotenbiopsie und Sampling über lappenspezifische systemische Dissektion bis hin zu radikaler und ausgeweiteter Lymphadenektomie.3,4
Unbestritten ist aber, dass das Ausmaß einer etwaigen Lymphknotenmetastasierung bei Patient:innen mit NSCLC einen sehr wichtigen Parameter im weiteren postoperativen Krankheitsverlauf mit signifikantem Einfluss auf die Prognose und somit das weitere Überleben der Patient:innen darstellt. Um im Falle des NSCLC eine vollständige Resektion erreichen zu können, wird entsprechend den Vorgaben in der Literatur eine komplette mediastinale Lymphadenektomie in allen Fällen von operablem NSCLC empfohlen. Die Argumente für eine komplette mediastinale Lymphadenektomie sind jedenfalls eine erhöhte Präzision des postoperativen Tumor-Stagings, eine verbesserte Indikationsstellung in Hinblick auf eine etwaige notwendige adjuvante Therapie, eine deutliche Verringerung der Lokalrezidivrate und somit eine Verlängerung des tumorfreien Überlebens.4
Aktuelle Aspekte in der onkologischen Thoraxchirurgie
Im Weiteren soll nun im Überblick auf zwei aktuelle Aspekte in der onkologischen Thoraxchirurgie eingegangen werden; zum einen auf die chirurgische Resektion der Frühstadien des NSCLC und zum anderen auf die Herausforderungen in der Chirurgie des lokal fortgeschrittenen NSCLC nach vorangegangener Induktionstherapie.
Parenchym-sparende Resektion: anatomische Segmentresektion
Aufgrund der Tatsache, dass durch die verbesserten Lebensumstände und durch den medizinischen Fortschritt unsere Patient:innen immer älter werden, ist auch eine deutliche Zunahme der altersbedingten Komorbiditäten zu verzeichnen, sodass die onkochirurgisch indizierte Lobektomie aufgrund mangelnder kardiopulmonaler Reserve nicht immer durchgeführt werden kann. In diesem Fall gilt wahrheitsgemäß „weniger ist mehr“. Hier stellt die Sublobarresektion des Lungenkarzinoms, eine Form der Lungenparenchym-erhaltenden Resektion, eine sehr gute chirurgische Alternative dar. Aber auch bei Patient:innen mit einem Frühstadium des NSCLC und ausreichender Lungenfunktion wird die Lobektomie schrittweise zugunsten der anatomischen Segmentresektion verlassen.1
Die onkochirurgische Indikation zur anatomischen Segmentresektion besteht grundsätzlich beim NSCLC in den Stadien IA1 und IA2. Das Karzinom sollte demnach keinen größeren Durchmesser als 2cm aufweisen und auch der mediastinale bzw. intrathorakale Lymphknotenstatus sollte negativ sein. Unabhängig davon sind die Grundvoraussetzungen für die anatomische Segmentresektion zum einen eine umfassende anatomisch-topografische Kenntnis der einzelnen Lungensegmente und zum anderen eine exakte chirurgische Präparations- und Resektionstechnik.
Wird dieser Eingriff auch noch in minimalinvasiver Technik durchgeführt, so verlangt die thorakoskopische Segmentektomie den Chirurg:innen zusätzliches Geschick ab und stellt zweifelsohne einen herausfordernden Eingriff dar. Die anfängliche Skepsis, dass die Segmentresektion beim Lungenkarzinom im Vergleich zur standardisierten Lobektomie mit einer schlechteren Überlebensrate und reduziertem tumorfreien Überleben verbunden wäre, hat sich nicht bewahrheitet. Zudem wird durch die verminderte Parenchymresektion Lungenfunktion bewahrt, ohne das Überleben zu kompromittieren. Im Laufe der vergangenen Jahre haben zahlreiche Studien und Metaanalysen bewiesen, dass die Segmentresektion im Frühstadium des Lungenkarzinoms der Lobektomie ebenbürtige (onkologische) Ergebnisse erzielt.5,6
Phase-III-Studie CALGB 140503
Im Rahmen der internationalen, multizentrischen Phase-III-Studie CALGB 140503 wurden 697 eingeschlossene Patient:innen präoperativ in zwei Gruppen randomisiert: einerseits Lobektomie, andererseits Sublobarresektion (davon 59% Keilresektionen).5 Der primäre Endpunkt war das tumorfreie Überleben, die sekundären Endpunkte umfassten das Gesamtüberleben, die Lungenfunktion nach sechs Monaten und das Tumorrezidiv. Die tumorfreie 5-Jahres-Überlebensrate zeigte für die Lobektomie 64,1% und für die Sublobarresektion 63,6% (p=0,0176). Die 5-Jahres-Gesamtüberlebensrate war 78,9% für die Lobektomie und 80,3% für die Sublobarresektion (p=0,014).
Die postoperative Lungenfunktion zeigte ebenso einen signifikanten Vorteil für die Gruppe der Sublobarresektionen (p=0,006). Ein Tumorrezidiv (lokoregionär bzw. distant) konnte in etwa 30% der Fälle in beiden Subgruppen beobachtet werden, jedoch ohne statistische Signifikanz. Die Post-hoc-Analyse zeigte hinsichtlich der perioperativen Morbidität und Mortalität keinen signifikanten Unterschied in beiden Gruppen.
Phase-III-Studie JCOG/WJOG
Ähnliche Ergebnisse zeigte die japanische Phase-III-Studie JCOG/WJOG,6 die mit 1106 rekrutierten Patient:innen ein deutlich größeres Kollektiv vorzuweisen hatte. Auch hier erfolgte die präoperative Randomisierung in zwei Gruppen: Lobektomie und Segmentresektion. Im Gegensatz zur Studie CALGB 140503 wurden jedoch keine Keilresektionen eingeschlossen, was bezüglich der besseren Vergleichbarkeit und der postoperativen onkologischen Prognose von Vorteil ist.
Der primäre Endpunkt war das Gesamtüberleben, die sekundären Endpunkte umfassten unter anderem das tumorfreie Überleben und die Lungenfunktion nach sechs bzw. zwölf Monaten. Hier konnte in der 5-Jahres-Gesamtüberlebensrate ein signifikanter Unterschied zwischen der Lobektomie (91,1%) und der Segmentektomie (94,3%) nachgewiesen werden (p=0,0082). Ebenso konnte auch hinsichtlich des tumorfreien 5-Jahres-Überlebens ein zarter Vorteil der Segmentresektion (88,0%) gegenüber der Lobektomie (87,9%) verzeichnet werden.6
Intraoperative Herausforderungen nach Induktionstherapie
Die kontinuierliche Weiterentwicklung in der Onkologie hat dazu geführt, dass immer mehr initial lokal fortgeschrittene NSCLC-Tumorstadien nach Durchführung einer präoperativen Induktionstherapie in operable Tumorstadien überführt und so einer potenziell kurativen chirurgischen Therapie zugeführt werden können.
Prinzipiell muss hier erwähnt werden, dass im Falle des lokal fortgeschrittenen NSCLC die technische Komplexität der anatomischen Lungenresektion a priori erhöht ist. Dieser Umstand ist u.a. der meist zentralen Lage des Tumors, der Tumorgröße, dem lappenüberschreitenden Wachstum und der Infiltration benachbarter Strukturen, Kompartimente oder Organe geschuldet. Nach erfolgreicher neoadjuvanter Systemtherapie kann dieser Umstand, so paradox es klingen mag, noch erheblich verschärft werden. Bedingt durch die inflammatorischen Prozesse in der tumoriziden Wirkung der Induktionstherapie kommt es zu einem zunehmenden Umbau des zuvor vitalen Tumorgewebes in Tumornekrose, aber auch hauptsächlich in Fibrose bzw. in derbes Narbengewebe.
Dies führt dazu, dass die chirurgische Präparation deutlich erschwert wird, da z.B. durch die Obliteration der perivaskulären bzw. peribronchialen Bindegewebsschichten keine gut darstellbaren Dissektionsebenen mehr erkennbar sind und somit die Gefahr der intraoperativen Blutung beträchtlich erhöht wird. Außerdem ist auch aufgrund der erschwerten oder unmöglichen chirurgischen Präparation die Wahrscheinlichkeit für eine erweiterte Resektion deutlich erhöht.
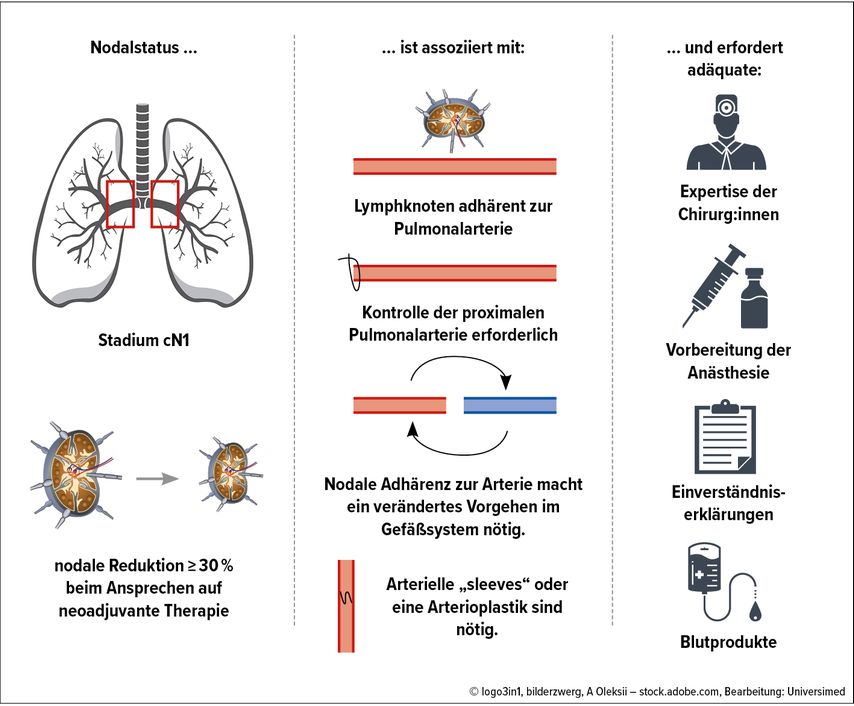
Diese erwähnten Faktoren konnten eindrücklich in einer klinischen Studie belegt werden, in der sich insbesondere die initial metastatisch befallenen N1-Lymphknoten nach durchgeführter Induktionstherapie als intraoperative Herausforderung erwiesen (Abb. 1).7
Abb. 1: Intraoperative Herausforderungen nach einer NSCLC-Induktionstherapie: der Effekt nodalpositiver Erkrankung auf die technische Komplexität(modifiziert nach Feldmann HA et al.7)
Von den 124 eingeschlossenen Patient:innen mit NSCLC-Stadium IIA bis IV wurden 86,3% einer neoadjuvanten Chemotherapie unterzogen. Über 90% wurden in weiterer Folge mit Lobektomie operiert, aufgrund des lokal fortgeschrittenen Tumorwachstums und der stattgefundenen Induktion erfolgte der Zugang in 86% der Fälle über eine Thorakotomie.Konkret zeigte sich, dass die N1-Lymphknoten, die aufgrund der durchgeführten Induktion eine im präoperativen CT messbare Reduktion des axialen Durchmessers um mindestens 30% aufwiesen, mit einer signifikant erhöhten Rate an komplexen Resektionen verbunden waren.
In diesen Fällen konnten die regressiv veränderten Lymphknoten aufgrund der fehlenden perivaskulären Dissektionsschicht und der damit verbundenen ausgeprägten Adhärenz an der Pulmonalarterie nicht gefahrlos vom Gefäß abpräpariert werden (p=0,023). Aus diesem Grunde waren ein (intraperikardiales) Anschlingen (p=0,03) bzw. Sichern des Pulmonalarterienhauptstamms (p=0,001) oder in weiterer Folge sogar angioplastische Resektionstechniken notwendig, die a priori nicht geplant waren (p<0,001).
Die Ergebnisse dieser Studie zeigen deutlich, dass ein präoperativ radiomorphologisch nachgewiesenes gutes Ansprechen auf die Induktionstherapie mit erhöhten intraoperativen chirurgischen Anforderungen verbunden sein kann. Aus diesem Grunde ist eine umfangreiche präoperative Planung bei dieser Subgruppe von Patient:innen nach stattgefundener Induktionstherapie unerlässlich. Dazu gehören neben einer exakten präoperativen funktionellen Abklärung der Patient:innen eine gründliche Aufklärung über den geplanten operativen Eingriff mit allen potenziell möglichen chirurgischen Varianten, die grundlegende thoraxchirurgische Expertise, eine ausführliche anästhesiologische Vorbereitung sowie eine reibungslose interdisziplinäre Kooperation mit entsprechendem Komplikationsmanagement.
Literatur:
1 Lindenmann J: Thoraxchirurgie 2023: Ist weniger mehr? Krebshilfe.2.32-33 2 Ginsberg RJ, Rubinstein LV: Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 1995; 60(3): 615-22 3 Meng D et al.: Lymphadenectomy for clinical early-stage non-small-cell lung cancer: a systematic review and meta-analysis. Eur J Cardiothorac Surg 2016; 50(4): 597-604 4 Lardinois DM et al.: ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg 2006; 30(5): 787-92 5 Altorki NK et al.: Perioperative mortality and morbidity after sublobar versus lobar resection for early-stage non-small-cell lung cancer: post-hoc analysis of an international, randomised, phase 3 trial (CALGB/Alliance 140503). Lancet Respir Med 2018; 6(12): 915-24 6 Saji H et al.: West Japan Oncology Group and Japan Clinical Oncology Group. Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open-label, phase 3, randomised, controlled, non-inferiority trial. Lancet 2022; 399(10335): 1607-17 7 Feldman HA et al.: Intraoperative challenges after induction therapy for non-small cell lung cancer: effect of nodal disease on technical complexity. JTCVS Open 2022; 12: 372-84
Das könnte Sie auch interessieren:
Prostatakarzinom: Screening, Diagnostik, Bildgebung, Biopsie und Optionen im lokalisierten und metastasierten Setting
Im April 2024 wurde ein Bericht der Lancet Commission on prostate cancer veröffentlicht, in welchem ein Anstieg der Prostatakarzinominzidenz von 1,4 Millionen 2020 auf 2,9 Millionen im ...
Nierenzellkarzinom: Update zu Diagnostik, Therapie und translationaler Forschung
Am diesjährigen EAU-Kongress in Paris fanden zahlreiche Sitzungen, Vorträge und Diskussionen zum Nierenzellkarzinom (RCC) statt. Es wurden Kontroversen in der initialen Diagnostik sowie ...
Fortschritte & Deeskalationsstrategien in der Therapie von Hoden- & Penistumoren
Am EAU-Kongress 2024 in Paris waren in den Vorträgen zur Therapie des Hoden- und Peniskarzinoms Langzeittoxizität und Deeskalation zwei der häufigsten Stichwörter. U.a. wurden mögliche ...