Le symposium «ASCO Genitourinary Cancers Symposium» fête son 20e anniversaire
Compte-rendu:
Dre Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Avec 5200inscriptions et 877résumés soumis, le symposium «ASCO Genitourinary Cancers Symposium» (ASCO GU) a fêté son 20eanniversaire au début de cette année. DrEric Small, président lors du premier ASCO GU, a rappelé que la première année du congrès avait été consacrée à la discussion sur la prolongation de la vie avec le docétaxel dans le cancer de la prostate. Quelque 20ans plus tard, il a maintenant été montré lors de l’ASCO GU comment des substances ciblées et des immunothérapies pouvaient améliorer le pronostic en cas de tumeurs de la vessie, de la prostate et du rein.
Carcinome urothélial: avantage cohérent avec un conjugué anticorps-médicaments (ADC) etl’immunothérapie
Le pronostic des patient·es atteint·es d’un carcinome urothélial avancé était très mauvais jusqu’à l’introduction des inhibiteurs de point de contrôle immunitaire. L’étude de phaseIII EV-302/KEYNOTE-A39 a comparé l’association du blocage de la voie PD-1 avec le pembrolizumab (P) et le conjugué anticorps-médicament (ADC) enfortumab vedotin (EV) à une chimiothérapie standard. L’étude comptait 886patient·es atteint·es d’un carcinome urothélial localement avancé ou métastatique jamais traité auparavant.
L’étude a atteint son double critère d’évaluation primaire, à savoir une prolongation de la survie sans progression (PFS) médiane de 6,3 à 12,5mois (HR: 0,45; IC à 95%: 0,38–0,54; p<0,0001) et de l’OS médiane de 16,1 à 31,5mois (HR: 0,47; IC à 95%: 0,38–0,58; p<0,0001). Les analyses de sous-groupes présentées à l’ASCO GU ont confirmé un bénéfice cohérent en termes de PFS et d’OS pour les patient·es admissibles ou non au cisplatine, les tumeurs avec une expression élevée ou faible de PD-L1 (CPS≥10 ou CPS<10), les patient·es avec ou sans métastases hépatiques, avec métastases viscérales ou avec atteinte ganglionnaire seulement.1 Dans tous les sous-groupes, une réponse a également été observée chez ≥60% des patient·es sous enfortumab vedotin+pembrolizumab. Dans le bras chimiothérapie, les taux de réponse sont restés inférieurs à 60%.
Sur la base des résultats de l’étude EV-302, le schéma EV+P devrait constituer un nouveau standard dans le traitement du carcinome urothélial localement avancé et métastatique, ont résumé les auteur·es.
Cancer de la prostate résistant à la castration métastatique (CPRCm): olaparib+abiratéron
Environ 20% des patients atteints de cancer de la prostate sont porteurs d’un gène de réparation de recombinaison homologue muté (HRRm). Ce groupe de patients pourrait bénéficier de l’inhibition ciblée de la PARP en situation de cancer métastatique résistant à la castration (CPRCm). Une étude randomisée de phaseII a cherché à savoir si l’inhibition simultanée du récepteur des androgènes (RA) et de PARP1 pouvait induire plus fréquemment une réponse et des rémissions plus longues par rapport aux monothérapies.2 Dans trois bras de l’étude, les patients présentant une mutation de BRCA1/2 ou une altération d’ATM ont reçu un traitement par abiratérone+prednisone (bras 1), par olaparib (bras 2) ou par olaparib+abiratérone/prednisone (bras 3). Le critère d’évaluation principal de l’étude était la PFS.
Sur 165patients inscrits, 61 présentaient des altérations qualifiantes et ont été randomisés dans les trois bras de l’étude. Les patients avaient un âge médian de 63, 68 et 69ans, avec un PSA médian de 14, 14 et 15ng/ml, 84%, 57% et 76% présentaient des métastases osseuses, et 11%, 14% et 33%, des métastases viscérales. Les mutations de BRCA2 étaient les plus fréquentes (68%, 90% et 71%), suivies des altérations d’ATM (21%, 14%, 24%).
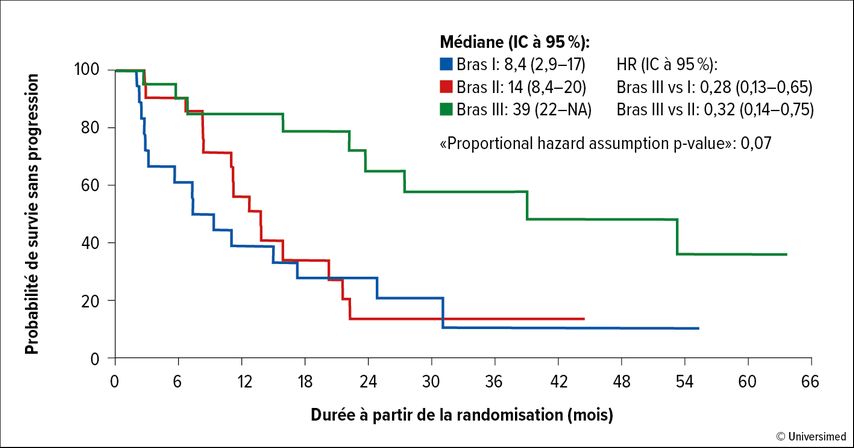
Le résultat a montré un avantage cliniquement significatif en termes d’efficacité avec le traitement d’association. La PFS médiane était de 8,4mois dans le bras 1, de 14mois dans le bras 2 et de 39mois dans le bras 3. En comparant les bras de l’étude, le risque de progression ou de décès a été réduit de 72% avec le traitement d’association par rapport au schéma abiratérone/prednisone (HR: 0,28; IC à 95%: 0,13–0,65) et par 68% par rapport à l’olaparib en monothérapie (HR: 0,32; IC à 95%: 0,14–0,75) (Fig. 1). Une réponse (ORR) a été observée chez 22% (bras 1), 14% (bras 2) et 33% (bras 3) des patients et une réponse du PSA, chez 61%, 67% et 95% des patients. Des taux de PSA indétectables ont été observés chez 17%, 14% et 33% des patients, respectivement.
Fig. 1: Survie sans progression (PFS) sous traitement par abiratérone plus prednisone (bras 1), olaparib (bras 2) ou olaparib plus abiratérone/prednisone (bras 3). (modifié d’après Hussain MHAetal.)2
En cas de progression dans les bras 1 et 2 de l’étude, une permutation vers les bras 2 et 1 était autorisée. Le traitement séquentiel a permis d’obtenir une réponse et une PFS médiane de 8,3mois chez 38% des patients lors de la permutation de l’abiratérone vers l’olaparib. Lors de la permutation de l’olaparib vers l’abiratérone, une réponse a été observée chez 25% des patients et la PFS médiane était de 7,2mois. Dans les deux bras de l’étude, la PFS médiane pour les patients ayant changé de traitement était de 16mois à partir de la randomisation. Les auteur·es ont conclu que les patients atteints de CPRCm avec des altérations des gènes BRCA1/2 ou ATM bénéficient davantage de l’association olaparib+abiratérone/prednisone en première ligne que des traitements individuels et que du traitement séquentiel.
Cancer de la prostate: arrêt de l’enzalutamide en cas de risque élevé
La récidive biochimique augmente le risque de décès chez les patients atteints de cancer de la prostate. L’enzalutamide est indiqué, entre autres, en association avec un traitement par privation androgénique (TPA) dans la prise en charge du cancer de la prostate métastatique hormono-sensible. L’étude de phaseIII à trois bras EMBARK comparait le traitement par enzalutamide vs acétate de leuprolide vs enzalutamide+acétate de leuprolide chez des patients affichant une récidive biochimique. Des patients atteints d’un cancer de la prostate avec un taux de PSA≥1ng/ml après une prostatectomie radicale ou au moins 2ng/ml au-dessus du nadir après une radiothérapie externe primaire (EBMT) ont été inclus. Le critère d’évaluation principal était la survie sans métastases (MFS) lorsque l’enzalutamide était ajouté au leuprolide.
Les patients ont été traités pendant une durée pré-spécifiée de 36semaines. Si le niveau de PSA était <0,2ng/ml à la semaine 37, le traitement était interrompu. Les résultats des patients des bras de l’étude sous enzalutamide en monothérapie ou sous leuprolide seul ont été présentés à l’ASCO GU.3 En tout, 304 patients (86%) des 355 du bras enzalutamide et 240patients (67%) des 358 du bras leuprolide ont cessé de prendre le médicament à la semaine 37. Les courbes de Kaplan-Meier pour la MFS étaient comparables entre le traitement par enzalutamide et le traitement par leuprolide chez les patients dont le traitement à l’étude a été arrêté (HR: 0,84; IC à 95%: 0,58–1,23; p=0,3659).
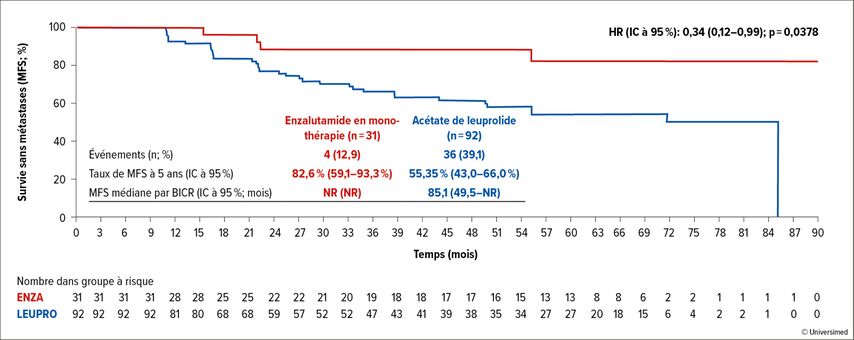
Après cinq ans, 80% vs 77,9% de ces patients étaient exempts de métastases. Les patients qui n’ont pas pu arrêter le traitement ont bénéficié d’une réduction de 66% du risque d’apparition de métastases lors de l’administration d’enzalutamide (HR: 0,34; IC à 95%: 0,12–0,99; p=0,0378; Fig. 2). Avec 4 vs 36 événements, le taux de MFS à 5 ans était de 82,6% dans le bras enzalutamide vs 55,3% dans le bras leuprolide. Après deux ans, moins de 10% des patients (4,6 vs 9,6%) présentaient toujours un taux de PSA indétectable.
Fig. 2: Survie sans métastases (MFS) sous traitement par enzalutamide (Enza) vs acétate de leuprolide (Leupro) chez les patient·es qui n’ont pas pu arrêter le traitement à la semaine 37 (modifié d’après Shore ND et al.)3
Cancer rénal
Avantage sur le plan de l’OS avec l’administration adjuvante de pembrolizumab
Pour la première fois depuis 1973, un traitement adjuvant expérimental a montré un avantage sur le plan de survie par rapport au traitement standard chez les patient·es atteint·es de carcinome rénal à cellules claires (CRCC). Les résultats positifs de l’étude de phaseIII KEYNOTE-564 ont déjà été présentés pour le critère d’évaluation principal, à savoir une survie sans maladie (DFS) significativement prolongée. Lors du congrès ASCO GU, ces résultats ont été confirmés par une troisième analyse pré-spécifique pour l’OS.4
Dans l’étude KEYNOTE-564, 496patient·es ont reçu du pembrolizumab et 498, un placebo, pendant une durée d’environ un an (≤17cycles). Le délai médian entre la randomisation et la date d’évaluation était de 57,2mois, et en décembre 2020, tous les participant·es à l’étude avaient terminé ou arrêté leur traitement.
L’évaluation à 4ans montre une réduction de 38% du risque de décès avec le traitement par pembrolizumab par rapport au placebo (HR: 0,62; IC à 95%: 0,44–0,87; p=0,002). Dans les deux bras de l’étude, l’OS médiane n’a pas encore été atteinte, après 48mois, le taux d’OS était de 91,2% vs 86%. L’avantage relatif à l’OS a été confirmé pour la plupart des sous-groupes. Cependant, chez les individus de sexe biologique féminin, l’analyse de sous-groupe de l’OS n’a pas mis en évidence d’avantage pour un bras de l’étude (HR: 1,08; IC à 95%: 0,57–2,04).
Les résultats actualisés pour la DFS confirment, avec 174 vs 224 événements, l’avantage de l’administration adjuvante de pembrolizumab (HR: 0,72; IC à 95%: 0,59–0,87). Après 48mois, 64,9% vs 56,6% des patient·es étaient exempt·es de la maladie. Les analyses de sous-groupes pour la DFS montrent également l’effet bénéfique du pembrolizumab dans pratiquement tous les sous-groupes, y compris les individus de sexe biologique féminin. Le groupe de CPS <1 pour le PD-L1 fait exception pour le critère DFS (HR: 0,91; IC à 95%: 0,58–1,44). Les données de sécurité n’avaient pas changé de manière substantielle depuis l’évaluation précédente.
Efficacité du double blocage immunitaire en première ligne de traitement
Dans l’étude de phase III CheckMate 214, on a comparé le traitement de première ligne du carcinome rénal au stade avancé par nivolumab (3mg/kg, q2w) plus ipilimumab (1mg/kg, q3w) vs sunitinib. Des données actualisées sur l’efficacité et la sécurité ainsi que des analyses exploratoires de sous-groupes ont pu être présentées à l’ASCO GU après une durée de suivi de huit ans.5
Dans la population en ITT, un avantage constant relatif à l’OS a été rapporté pour les patient·es sous double blocage immunitaire par rapport au sunitinib (HR: 0,72; IC à 95%: 0,62–0,83). Après 90mois, 31,1% des patient·es du bras traitement combiné étaient toujours en vie, vs 24,9% dans le bras sunitinib. L’OS médiane était de 52,7mois vs 37,8 mois. Chez les patient·es présentant un risque de progression moyen ou élevé, le risque de décès était réduit de 31% (HR: 0,69; IC à 95%: 0,59–0,81). L’OS médiane était de 46,7mois vs 26,0mois, et après 90mois, le taux d’OS était de 32,9% vs 22,0%.
Chez les patient·es présentant un faible risque de progression, on a observé au début du traitement un taux d’OS plus élevé sous sunitinib, qui était encore en faveur du sunitinib après 24mois (85,1% vs 88,4%). Les courbes de Kaplan-Meier se sont croisées après environ 50mois et ont montré un avantage lié à la survie avec immunothérapie à partir de ce moment-là. Après 72mois, le taux d’OS était de 52,3% vs 46,4% et après 90mois, de 42,8% vs 34,4%.
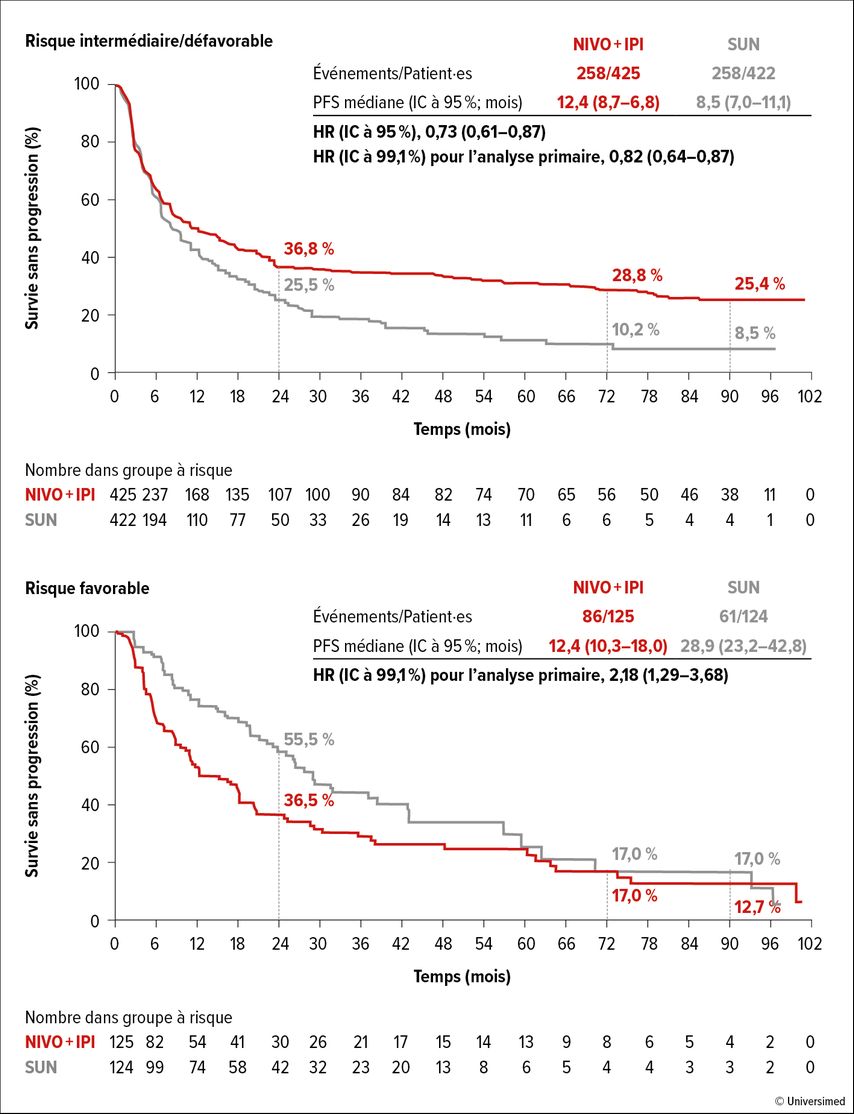
En ce qui concerne la PFS, les données actualisées ont confirmé l’atteinte d’un plateau pour les deux bras de l’étude. Dans la population en ITT, le taux de PFS était de 26,2% (72mois) et de 22,8% (90mois) dans le bras d’étude nivolumab+ipilimumab, et de 12,0% et 10,8% respectivement pour le bras contrôle. Dans les différents groupes à risque, on a vu des courbes de PFS systématiquement séparées avec l’association de blocage immunitaire pour les patient·es à risque moyen et élevé, tandis que pour les patient·es à faible risque, les courbes de Kaplan-Meier se rejoignaient après environ 60mois (Fig. 3).
Fig. 3: Survie sans progression (PFS) sous traitement par nivolumab plus ipilimumab (Nivo+Ipi) versus sunitinib (Sun) en fonction du risque de récidive (modifié d’après Tannir NM et al.)5
On a relevé une réponse aux médicaments à l’étude chez 39% vs 33% des patient·es de la population en ITT, 42% vs 27% des patient·es à risque moyen ou élevé et 30% vs 52% des patient·es à faible risque. Une rémission complète a été observée chez 12% vs 3% (population en ITT), 12% vs 3% (risque moyen et élevé) et 13% vs 6% (risque faible) des patient·es. La durée médiane de la réponse dans la population en ITT était de 76,2mois vs 25,1mois (HR: 0,52; IC à 95%: 0,38–0,72). Une analyse de sous-groupe relative à la localisation des métastases a montré que les patient·es présentant des métastases pulmonaires tiraient le meilleur profit du double blocage immunitaire tandis que les patient·es présentant uniquement des métastases osseuses pouvaient bénéficier de manière comparable du schéma nivolumab+ipilimumab ou de sunitinib, du moins en termes de PFS.
Source:
ASCO Genitourinary Cancers Symposium (ASCO GU), 25–27janvier2024, San Francisco, États-Unis et en ligne
Littérature:
1 Van der Heijden MS et al.: Enfortumab vedotin in combination with pembrolizumab vs. chemotherapy in previously untreated locally advanced metastatic urothelial carcinoma: subgroup analyses results from EV-302, aphase 3 global study. ASCO GU 2024; Abstr. #LBA530 2 Hussain MHA et al.: BRCAAway: a randomized phase 2 trial of abiraterone, olaparib, or abiraterone + olaparib in patients with metastatic castration-resistant prostate cancer bearing homologous recombination-repair mutations (HRRm). ASCO GU 2024; Abstr. #19 3 Shore ND et al.: Outcomes of men with high-risk biochemically recurrent prostate cancer who suspended enzalutamide monotherapy treatment in the phase 3 EMBARK study. ASCO GU 2024; Abstr. #15 4 Choueiri TK et al.: Overall survival results from the phase 3 KEYNOTE-564 study of adjuvant pembrolizumab vs. placebo for the treatment of clear cell renal cell carcinoma (ccRCC). ASCO GU 2024; Abstr. #LBA359 5 Tannir NM et al.: Nivolumab plus ipilimumab vs sunitinib for first-line treatment of advanced renal cell carcinoma (aRCC): long-term follow-up data from the phase 3 CheckMate 214 trial. ASCO GU 2024; Abstr. #363
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...