Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Auteure:
Dre méd. Stefani Parmentier
Leitende Ärztin Hämatologie
St. Claraspital Basel
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques personnalisées qui améliorent le pronostic et la qualité de vie des patient·es. Cet article de synthèse examine les plus récents développements et stratégies thérapeutiques pour les patient·es atteint·es de MDS à faible risque et à haut risque et souligne l’importance des plans de traitement individualisés dans l’hématologie moderne.
Keypoints
-
Les approches thérapeutiques personnalisées des MDS ont un impact significatif sur la survie et la qualité de vie des patient·es.
-
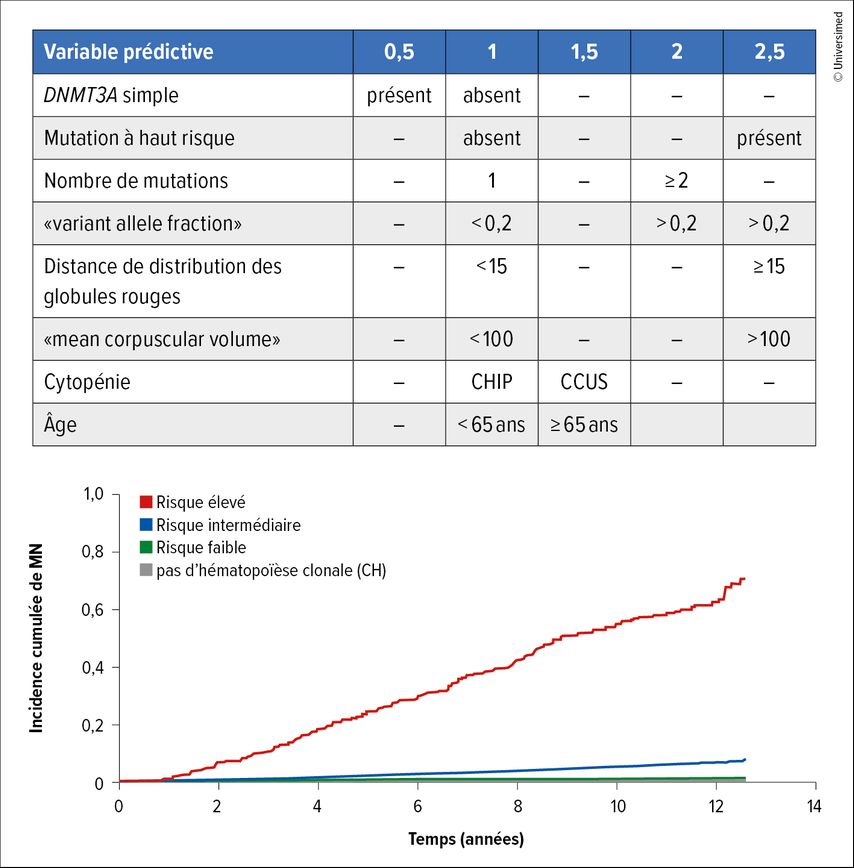
Des outils complets de stratification du risque comme l’IPSS-R et l’IPSS-M, y compris les profils moléculaires et le Clonal Hematopoiesis Risk Score (CHRS), sont essentiels pour identifier les patient·es à risque accru de progression.
-
Les thérapies innovantes, comme les agents ciblés et les médicaments immunomodulateurs, modifient fondamentalement la prise en charge des MDS.
-
Des interventions précoces, avant même le diagnostic d’un MDS manifeste, pourraient éventuellement influencer positivement l’évolution de la maladie («pré-MDS» comme l’hématopoïèse clonale à potentiel indéterminé [CHIP] et la cytopénie clonale de signification indéterminée [CCUS]).
Depuis la classification de 2022 de l’OMS, le terme «néoplasies myélodysplasiques» est utilisé, mais l’abréviation «MDS» est restée;1 dans la classification ICC, on parle cependant toujours de syndromes myélodysplasiques – la terminologie plus récente peut être lue comme «néoplasies MyéloDysplaSiques» pour correspondre encore à l’abréviation.
Les MDS sont un groupe hétérogène de maladies clonales de la cellule souche hématopoïétique, caractérisées par une hématopoïèse dysplasique et inefficace. Il en résulte des cytopénies périphériques plus ou moins prononcées (avec le plus souvent une anémie comme symptôme principal) et un risque accru de transformation en leucémie myéloïde aiguë (LMA). La médecine personnalisée, basée sur les connaissances moléculaires, révolutionne de plus en plus les possibilités thérapeutiques et permet des approches thérapeutiques personnalisées.
Diagnostic et épidémiologie
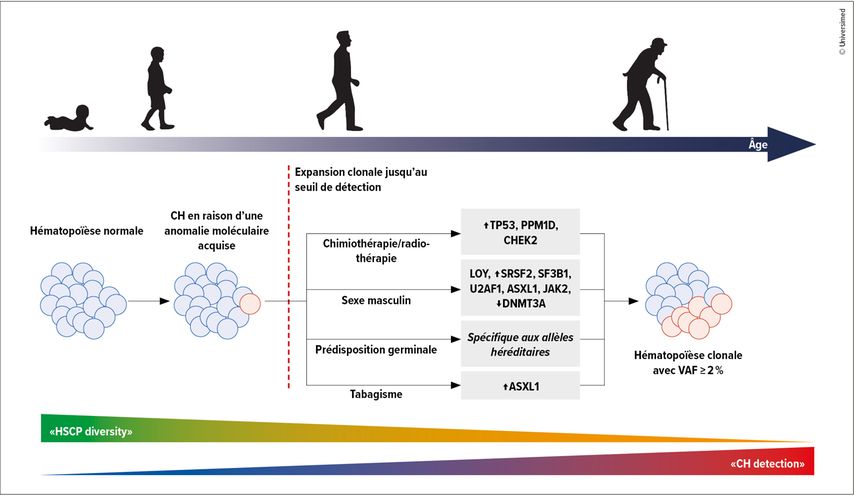
Les données épidémiologiques montrent qu’environ 60 à 70% des cas de MDS sont classés comme MDS à faible risque (LR-MDS) selon le système international de scoring pronostique révisé (IPSS-R). Les patient·es atteint·es de LR-MDS présentent souvent des cytopénies asymptomatiques, mais nécessitent une surveillance étroite en raison du potentiel de progression. La stratification du risque moléculaire, y compris les mutations somatiques et le score de risque d’hématopoïèse clonale (CHRS, Clonal Hematopoiesis Risk Score), améliore la précision du pronostic en identifiant les modifications génétiques à haut risque. Cette stratification est cruciale pour les décisions thérapeutiques et les interventions précoces chez les patient·es présentant une forte probabilité de progression (Fig.1 et 2).2,3
Paysage thérapeutique actuel
Outre l’âge, l’état général et les comorbidités, le traitement des MDS est basé sur des scores de risque, les objectifs thérapeutiques étant différents pour les patient·es à faible risque et les patient·es à haut risque.
Recommandation pour le LR-MDS
-
Réduction des cytopénies et diminution ou prévention de la dépendance à la transfusion
-
Amélioration de la qualité de vie grâce à des mesures de soutien telles que, entre autres, l’administration de transfusions d’érythrocytes et la chélation du fer
-
Utilisation d’agents stimulant l’érythropoïèse (ASE) pour corriger l’anémie
Pour les MDS à haut risque (HR-MDS)
-
Focalisation sur la modification de l’évolution de la maladie et la prévention de la progression vers la LMA
-
Substances hypométhylantes (HMA) comme l’azacitidine et la décitabine dans le traitement standard de première intention
-
Transplantation de cellules souches allogéniques comme option curative potentielle, limitée par l’âge et les comorbidités des patient·es
Malgré ces traitements, le pronostic des patient·es atteint·es de HR-MDS reste défavorable, avec une survie globale médiane souvent inférieure à deux ans après un traitement par HMA, ce qui souligne le besoin de traitements plus efficaces et mieux tolérés.
Nouvelles thérapies et nouveaux concepts
Intervention précoce en cas de pré-MDS
L’identification d’états tels que CHIP et CCUS ouvre de nouvelles possibilités d’intervention.
Les personnes atteintes de CHIP portent des mutations somatiques sans cytopénies manifestes, tandis que les patient·es atteint·es de CCUS présentent des cytopénies inexpliquées avec des mutations clonales, mais sans preuve de dysplasie morphologique. Ces deux états sont associés à un risque accru de MDS, de LMA et de maladies cardiovasculaires.
Les études actuelles examinent les stratégies de surveillance et les interventions thérapeutiques précoces afin de retarder ou d’empêcher l’apparition de la maladie. Les patient·es présentant un CCUS à haut risque ont une évolution similaire à celle des patient·es atteint·es de LR-MDS.2,3
Dans ce domaine, des stratégies telles que l’administration de fortes doses de vitamine C dans les CCUS et les MDS avec mutation de TET2,4 l’utilisation précoce de l’énasidenib (étude de phaseI),5 le canakinumab (étude de phaseII)6 ainsi que la metformine, qui pourrait éventuellement jouer un rôle dans les CHIP/CCUS avec une mutation de DNMT3A-R882 (étude de phaseII), sont actuellement à l’étude.7 Les résultats à ce sujet sont attendus.
LR-MDS: thérapies ciblées
Luspatercept et substances similaires
-
Le luspatercept sert de «piège à ligand» pour les récepteurs de l’activine et module la signalisation du TGFβ pour favoriser l’érythropoïèse.
-
Les études MEDALIST8 et COMMANDS9 ont montré une réduction significative des besoins transfusionnels et une amélioration du taux d’hémoglobine chez les patient·es atteint·es de LR-MDS avec sidéroblastes en anneau et/ou mutation de SF3B1.
-
L’étude de phaseIII ELEMENT-MDS évalue l’utilisation précoce du luspatercept ou de l’EPO avant la dépendance transfusionnelle.10
-
Une substance plus récente est l’elritercept (KER-050). L’étude de phaseII KER050-MD-201 a montré de très bons taux de réponse dans les LR-MDS, même avec des besoins transfusionnels élevés.11
Lénalidomide
-
Médicament immunomodulateur particulièrement efficace chez les patient·es porteur·euses de la mutation del(5q)
-
L’étude MDS-004 a montré un taux élevé d’indépendance vis-à-vis de la transfusion.12
-
L’étude de phaseIII SintraREV a également montré une efficacité pour une utilisation précoce du lénalidomide.13
Imételstat
-
L’imételstat est un inhibiteur de la télomérase qui, sur la base des données de l’étude de phaseIII IMerge,14 a été approuvé aux États-Unis chez les patient·es atteint·es de LR-MDS et dépendant·es des transfusions qui ne répondent pas à l’ASE ou qui deviennent réfractaires au cours du traitement.
-
Lors du congrès annuel 2024 de l’EHA, les données étendues de l’étude ont été présentées, montrant une indépendance transfusionnelle chez 18% des participant·es (vs 2% pour le placebo), même après un an.
HR-MDS: des approches innovantes
Inhibiteurs de l’IDH
-
Environ 3 à 12% des patient·es atteint·es de MDS présentent une mutation d’IDH, qui est considérée comme une mutation pilote pour l’évolution vers la LMA et qui est associée à un mauvais pronostic.15–17 L’ivosidénib (IDH1) et l’énasidénib (IDH2) ont été approuvés par la FDA aux États-Unis pour le traitement de la LMA.
-
Des agents tels que l’ivosidénib (inhibiteur de l’IDH1) et l’énasidénib (inhibiteur de l’IDH2) présentent des résultats prometteurs et font l’objet d’autres études, notamment en combinaison avec les HMA.18,19
Thérapies ciblées par RARα
-
Environ 50% des patient·es atteint·es de MDS présentent une surexpression de RARα.
-
Actuellement, le tamibarotène, un agoniste du RARα, est étudié en combinaison avec l’azacitidine dans le cadre d’une étude de phaseIII dans le HR-MDS récemment diagnostiqué.20 Les résultats sont en attente. Une étude de phaseII chez des patient·es atteint·es de LMA a montré une réponse complète chez 61% des patient·es.21
Eltanexor (KPT-8602) et HMA de «deuxième génération»
-
L’eltanexor, un inhibiteur sélectif de l’exportation nucléaire, montre une activité dans les MDS réfractaires aux HMA.22
-
De nouveaux HMA aux propriétés pharmacocinétiques améliorées sont en cours de développement afin de surmonter les résistances et d’augmenter l’efficacité.23,24
CPX-351 (Vyxeos)
-
Dans une étude de phaseII, un taux de réponse de 87% a été obtenu chez des patient·es aptes à la transplantation et atteint·es de HR-MDS récemment diagnostiqués et de leucémie myélomonocytaire chronique (LMMC), 94% des patient·es ayant reçu une greffe de cellules souches allogéniques.25
-
D’autres études sont actuellement en cours dans les MDS récemment diagnostiqués et dans les MDS post-échec des HMA.26,27
Inhibiteurs de BCL2
-
La protéine BCL2 est surexprimée dans les néoplasies hématologiques, en corrélation inverse avec la réponse aux HMA et la survie. Jusqu’à présent, la plupart des études portaient sur la LMA.28
-
De plus en plus d’études sont maintenant menées sur les MDS et la LMMC.29,30 D’autres études de phaseII/III sont en cours.31,32
Perspectives d’avenir et conclusion
Le traitement des MDS est en train d’évoluer, sous l’impulsion des diagnostics moléculaires et des thérapies ciblées. Les approches personnalisées, basées sur les profils génétiques et épigénétiques, promettent d’améliorer les taux de survie et la qualité de vie des patient·es.
Les recherches futures devraient se concentrer sur l’intégration de nouveaux principes actifs dans les traitements standard, l’optimisation des traitements d’association et l’identification de biomarqueurs prédictifs. De plus, des interventions précoces dans les états pré-MDS pourraient modifier fondamentalement la prise en charge des néoplasies myéloïdes.
Littérature:
1 Khoury JD et al.: The 5th edition of the World Health Organization Classification of haematolymphoid tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia 2022; 36(7): 1703-19 2 Weeks LD, Ebert BL: Causes and consequences of clonal hematopoiesis. Blood 2023; 142(26): 2235-46 3 Weeks LD et al.: Prediction of risk for myeloid malignancy in clonal hematopoiesis. NEJM Evid 2023; 2(5): 10.1056/evidoa2200310 4 Mikkelsen SU et al.: EVITA/NCT03682029: Vitamin C supplementation in patients with clonal cytopenia of undetermined significance or low-risk myeloid malignancies: results from EVI-2, arandomized, placebo-controlled phase 2 study. EHA 2024; Abstr. #LB3444 5 NCT05102370: A pilot study of enasidenib in people with clonal cytopenia of undetermined significance and mutations in IDH2 6 IMPACT/NCT05641831: Canakinumab for the prevention of progression to cancer in patients with clonal cytopenias of unknown significance, IMPACT study 7NCT04741945: Repurposing metformin as a leukemia-preventive drug in CCUS and LR-MDS 8 Germing U et al.: Improved benefit of continuing luspatercept therapy: sub-analysis of patients with lower-risk MDS in the MEDALIST study. Ann Hematol 2023; 102(2): 311-21 9Platzbecker U et al.: Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet 2023; 402(10399): 373-85 10Zeidan AM et al.: The ELEMENT-MDS Trial: aphase 3 randomized study evaluating luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, non-transfusion-dependent, lower-risk myelodysplastic syndromes. Blood 2023; 142(Suppl 1): 6503 11 Diéz Campelo M et al.: Durable clinical benefit with elritercept (KER-050) treatment: findings from an ongoing phase 2 trial in participants with lower-risk MDS. EHA 2024; Abstr. #S183 12Fenaux P et al.: A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with low-/intermediate-1-risk myelodysplastic syndromes with del5q. Blood 2011; 118(14): 3765-76 13 Cadenas FLL, Gonzalez T: Evaluation of lenalidomide (len) vs placebo in non-transfusion dependent low risk del(5q) MDS patients. Final results of Sintra-REV phase III international multicenter clinical trial. Blood 2022; 140 14Platzbecker U et al.: Imetelstat in patients with lower-risk myelodysplastic syndromes who have relapsed or are refractory to erythropoiesis-stimulating agents (IMerge): a multinational, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2024; 403(10423): 249-60 15Patnaik MM et al.: WHO-defined ‚myelodysplastic syndrome with isolated del(5q)‘ in 88 consecutive patients: survival data, leukemic transformation rates and prevalence of JAK2, MPL and IDH mutations. Leukemia 2010; 24(7): 1283-9 16Patnaik MM et al.: Differential prognostic effect of IDH1 versus IDH2 mutations in myelodysplastic syndromes: aMayo Clinic study of 277 patients. Leukemia 2012; 26(1): 101-5 17 Lin CC et al.: IDH mutations are closely associated with mutations of DNMT3A, ASXL1 and SRSF2 in patients with myelodysplastic syndromes and are stable during disease evolution. Am J Hematol 2014; 89(2): 137-44 18DiNardo CD et al.: Targeted therapy with the mutant IDH2 inhibitor enasidenib for high-risk IDH2-mutant myelodysplastic syndrome. Blood Adv 2023; 7(11): 2378-87 19 Sébert M et al.: Ivosidenib monotherapy in IDH1 mutated myelodysplastic syndrome, final results of the idiome trial, a GFM study. EHA 2024; Abstr. #S182 20 Dezern AE et al.: A randomized, double-blind, placebo-controlled study of tamibarotene/azacitidine versus placebo/azacitidine in newly diagnosed adult patients selected for RARA+ HR-MDS (SELECT-MDS-1). J Clin Oncol 2022; 40(Suppl 16): Abstr. #TPS7075 21 De Botton S et al.: Targeting RARA overexpression with tamibarotene, a potent and selective RARalpha agonist, is a novel approach in AML. Blood Adv 2023; 7(9): 1858-70 22 Lee S et al.: Oral eltanexor treatment of patients with higher-risk myelodysplastic syndrome refractory to hypomethylating agents. J Hematol Oncol 2022; 15(1): 103 23Garcia-Manero G et al.: Oral decitabine-cedazuridine versus intravenous decitabine for myelodysplastic syndromes and chronic myelomonocytic leukaemia (ASCERTAIN): a registrational, randomised, crossover, pharmacokinetics, phase 3 study. Lancet Haematol 2024; 11(1): e15-26 24 Garcia-Manero G et al.: Guadecitabine (SGI-110) in patients with intermediate or high-risk myelodysplastic syndromes: phase 2 results from a multicentre, open-label, randomised, phase 1/2 trial. Lancet Haematol 2019; 6(6): e317-27 25Peterlin P et al.: CPX-351 in higher risk myelodysplastic syndrome and chronic myelomonocytic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Haematol 2023; 10(7): e521-9 26 PALOMA/NCT04061239: Primary comparison of liposomal anthracycline based treatment versus conventional care strategies before allogeneic stem cell transplantation in patients with higher risk MDS and oligoblastic AML – the PALOMA study 27NCT03957876: CPX-351 therapy for MDS after hypomethylating agent failure 28El-Cheikh J et al.: Venetoclax: anew partner in the novel treatment era for acute myeloid leukemia and myelodysplastic syndrome. Clin Hematol Int 2023; 5(2-3): 143-54 29 Zeidan AM et al.: A phase 1b study of venetoclax and azacitidine combination in patients with relapsed or refractory myelodysplastic syndromes. Am J Hematol 2023; 98(2): 272-81 30 Wei AH: Maintenance therapy for AML: are we there yet? Blood 2019; 133(13): 1390-2 31 NCT05782127: Oral azacitidine combined with venetoclax in previously untreated higher-risk myelodysplastic syndromes 32NCT04401748: Study of venetoclax tablet with intravenous or subcutaneous azacitidine to assess change in disease activity in adult participants with newly diagnosed higher-risk myelodysplastic syndrome (Verona)
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Intégration de nouveaux traitements dans le CPHSm et le CPRCm
Aujourd’hui, le cancer de la prostate est un exemple de maladie dont le traitement est hautement personnalisé et de longue durée, et pour laquelle des optimisations sont possibles en ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...