Parfois, il suffit d’attendre
Compte-rendu:
Dre méd. Judith Moser
Auteur:
PD Dr méd. Aurelius Omlin
Onkozentrum Zürich und Chairman Uroonkologisches Zentrum
Hirslanden Zürich
E-mail: aurelius.omlin@ozh.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et avancée s’oriente sur un certain nombre de facteurs. Si le pronostic est très bon, il peut être indiqué de ne faire que du «watchful waiting» (surveillance attentive).
Dans le cas du carcinome à cellules rénale (CCR) précoce, le modèle de Leibovich renseigne sur la probabilité individuelle de survie spécifique au cancer au cours des 15 prochaines années et peut donc aider à évaluer le risque.1 Sur le plan thérapeutique, dans le domaine des inhibiteurs de tyrosine kinase (ITK), seul le sunitinib a montré un avantage en termes de survie sans maladie (DFS) dans le cadre d’un traitement adjuvant.2 Cinq autres études menées avec d’autres ITK se sont révélées négatives.
La situation est similaire en ce qui concerne les inhibiteurs de points de contrôle (IPC). L’étude KEYNOTE-564 a démontré un bénéfice sur le plan de la DFS pour le pembrolizumab adjuvant par rapport au placebo (HR: 0,63; p<0,0001).2 Cet IPC s’est également avéré significativement supérieur en termes de taux de survie globale à 48 mois (91,2% vs 86,0%).3 En revanche, trois autres études n’ont pas démontré de bénéfice sur le plan de la DFS avec l’atézolizumab ou le nivolumab, avec ou sans ipilimumab.2
Recommandations en situation adjuvante
Les directives internationales s’accordent à dire qu’un traitement adjuvant par pembrolizumab peut être envisagé en cas de CCR précoce.4–6 Il est recommandé d’informer les patient·es des effets secondaires potentiels et du fait que plusieurs études n’ont pas montré de bénéfices.
Dans l’ensemble, la personnalisation représente l’aspect le plus important dans le traitement adjuvant du CCR. Dans mon service, le cas des patient·es font l’objet de discussions avant et après l’intervention chirurgicale au sein du tumorboard. En présence d’une histologie à cellules claires et si les critères de traitement adjuvant sont réunis, une consultation oncologique et une évaluation clinique sont effectuées, ainsi qu’un calcul de risque selon le modèle de Leibovich. Les avantages et les inconvénients du traitement sont discutés et une décision individuelle est prise. Il n’y a actuellement aucune indication de traitement adjuvant pour les histologies non à cellules claires.
Si une progression survient pendant ou après un traitement adjuvant, la procédure dépend de l’ampleur de la progression.7 En cas de récidive oligométastatique, des mesures locales (métastasectomie, irradiation stéréotaxique) ou une simple surveillance active peuvent être envisagées. En revanche, si l’on suppose qu’il s’agit d’une résistance primaire (progression dans les trois mois), un traitement par ITK est recommandé. Les patient·es présentant une récidive précoce (progression après 3 à 12 mois) doivent également recevoir un ITK seul ou, dans certains cas sélectionnés, en plus de l’IPC. Dans le cas des récidives ultérieures, l’administration d’un ITK est à nouveau envisagée en premier lieu, mais aussi une stratégie combinée ITK/IPC ou IPC/IPC.
CCR métastatique: réserve en cas de bon pronostic
Dans le cadre du CCR métastatique, la prise de décision individuelle est également au centre des préoccupations, compte tenu du grand nombre d’options disponibles. Pour cela, l’évaluation clinique, les comorbidités/médicaments, les valeurs de laboratoire, y compris l’hémogramme, les valeurs de la fonction rénale et hépatique, le taux de CRP et la calcémie, sont tout aussi déterminants que l’imagerie (TDM, éventuellement IRMc, scintigraphie) et l’histologie. Un conseil génétique semble surtout indiqué en cas d’âge du patient ou de la patiente <47 ans, de tumeurs bilatérales ou multifocales et d’antécédents familiaux. Le score de risque IMDC permet également, à l’ère des combinaisons IPC/IPC ou ITK/IPC, de bien différencier les trois groupes de risque: favorable, intermédiaire et défavorable.8
Des données présentées en 2024 ont montré que chez les patient·es présentant un profil de risque très favorable (délai depuis le diagnostic >3 ans, pas de métastases au niveau du SNC, du foie ou des os, indice fonctionnel de 90 à 100%), une surveillance peut suffire.9 En cas d’oligométastases, un traitement focal peut être suffisant. Dans l’ensemble, les données n’ont pas démontré d’avantage de l’association ITK/IPC par rapport au ITK en monothérapie en cas de pronostic favorable. Cependant, l’association d’ipilimumab et de nivolumab a entraîné un bénéfice en termes de survie globale (OS) à long terme et a donc été incluse comme option dans le groupe de pronostic favorable dans les directives de l’ESMO et du NCCN.4,5,10
Différenciation entre les ITK
Pour les patient·es ayant un pronostic intermédiaire/défavorable selon l’IMDC, les schémas IPC/IPC et ITK/IPC constituent la norme de traitement.4,5 Les directives répertorient les associations sans les classer, mais il existe de facto des différences entre les ITK en termes de mécanisme d’action et de demi-vies.11 Le récepteur du VEGF est généralement la cible la plus importante. Le lenvatinib s’attaque en plus au FGFR, tandis que le cabozantinib présente un spectre plus large. L’axitinib séduit par sa demi-vie de loin la plus courte de tous les ITK et par sa posologie flexible.
Une prise en charge précoce des effets secondaires contribue à maintenir les patient·es plus longtemps sous traitement. Il existe parfois un chevauchement des toxicités avec le nivolumab et le cabozantinib, comme des éruptions cutanées ou des diarrhées.12 Des ajustement posologiques sont nécessaires chez presque tous les patient·es traité·es par ITK. Les toxicités immuno-associées des IPC sont connues et peuvent être traitées avec les mesures établies.
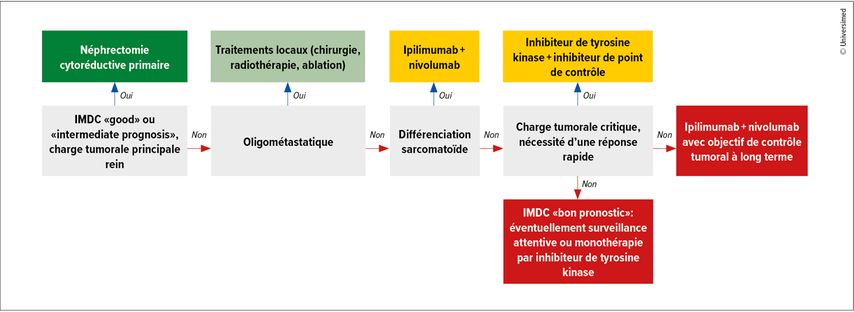
La Figure 1 montre un algorithme possible en cas de CCR à cellules claires métastatique.13 Initialement, une néphrectomie cytoréductive semble surtout judicieuse lorsque la charge tumorale principale provient du rein. En cas d’oligométastase, un traitement local doit être mis en place si possible, et en cas de différenciation sarcomatoïde, un traitement combiné IPC/IPC doit être mis en place en premier lieu. Si une réponse rapide est nécessaire, une combinaison ITK/IPC est envisagée en priorité, sinon le schéma nivolumab/ipilimumab, un ITK en monothérapie ou une surveillance attentive.
Fig.1: Algorithme de traitement possible en cas de carcinome rénal à cellules claires métastatique (modifiée selon Braun DA)13
CCR non à cellules claires: nouvelles données
Dans le cadre du CCR non à cellules claires, il n’existe pas de niveau de preuve élevé en raison de la rareté des tumeurs. Les directives mentionnent une palette d’options en fonction du sous-type.4 Lors du congrès annuel 2024 de l’ESMO, une étude intéressante (SUNNIFORECAST) ayant montré un avantage en termes d’OS avec le schéma ipilimumab/nivolumab par rapport au traitement standard (86,9% vs 76,8% à 12 mois) a été présentée.14 Il semble envisageable d’intégrer cette combinaison dans les directives.
Pour toutes les tumeurs, l’importance de contrôles réguliers afin d’évaluer l’efficacité et la toxicité du traitement ne fait aucun doute. Une étroite collaboration entre l’équipe soignante et les patient·es est essentielle pour obtenir des résultats optimaux.
Littérature:
1 Leibovich BC et al.: Predicting oncologic outcomes in renal cell carcinoma after surgery. Eur Urol 2018; 73(5): 772-80 2 Boyle JJ et al.: Adjuvant therapy for renal cell carcinoma: end points, outcomes, and risk assessments. JCO Precis Oncol 2023; 7: e2200407 3 Choueiri TK et al.: Overall survival with adjuvant pembrolizumab in renal-cell carcinoma. N Engl J Med 2024; 390(15): 1359-71 4 Escudier B et al.: Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019; 30(5): 706-20 5 NCCN Guidelines Kidney Cancer, Version 2.2025, September 6, 2024 6 Ljungberg B et al.: EAU Guidelines on Renal Cell Carcinoma, Limited Update, March 2024 7 Bourlon MT et al.: ASCO Daily News, 10. Januar 2024 8 Ernst MS et al.: Outcomes for International Metastatic Renal Cell Carcinoma Database Consortium prognostic groups in contemporary first-line combination therapies for metastatic renal cell carcinoma. Eur Urol 2023; 84(1): 109-16 9 Plimack ER et al.: Pembrolizumab plus axitinib versus sunitinib as first-line treatment of advanced renal cell carcinoma: 43-month follow-up of the phase 3 KEYNOTE-426 study. Eur Urol 2023; 84(5): 449-54 10 Tannir NM et al.: Nivolumab plus ipilimumab versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended 8-year follow-up results of efficacy and safety from the phase III CheckMate 214 trial. Ann Oncol 2024; 35(11): 1026-103 11 Puissent F et al.: Therapeutic drug monitoring of tyrosine kinase inhibitors in the treatment of advanced renal cancer. Cancers (Basel) 2023; 15(1): 313 12 McGregor B et al.: Management of adverse events associated with cabozantinib plus nivolumab in renal cell carcinoma: a review. Cancer Treat Rev 2022; 103: 102333 13 Braun DA: Harnessing the immune system in renal cell carcinoma: current and novel immunotherapy approaches. ASCO 2023; oral presentation 14 Bergmann L et al.: Prospective randomised phase-II trial of ipilimumab/nivolumab versus standard of care in non-clear cell renal cell cancer: results of the SUNNIFORECAST trial. ESMO 2024; Abstr. #LBA75
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Intégration de nouveaux traitements dans le CPHSm et le CPRCm
Aujourd’hui, le cancer de la prostate est un exemple de maladie dont le traitement est hautement personnalisé et de longue durée, et pour laquelle des optimisations sont possibles en ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...