Cancer de l’endomètre métastatique, avancé et récidivant
Auteure:
Dre méd. (HR) Tamara Rordorf
Klinik für Medizinische Onkologie und Hämatologie
USZ – Universitätsspital Zürich
E-mail: tamara.rordorf@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de réparation des mésappariements, mais pour d’autres sous-groupes, les données disponibles à ce jour ne montrent un certain effet que chez une partie des patient·es. L’article suivant donne un aperçu de l’état des études.
Le cancer de l’endomètre (CE) se manifeste souvent à un stade précoce par des saignements post-ménopausiques. De ce fait, le diagnostic est souvent posé tôt et la maladie est traitée en premier lieu par voie chirurgicale, avec de bonnes chances de guérison. Pour les stades localement avancés, métastatiques et récidivants, le pronostic est malheureusement mauvais. Par exemple, le taux de survie à 5 ans des patient·es présentant un cancer métastatique est inférieur à 20%.
La classification moléculaire en quatre groupes, élaborée initialement par le TCGA Consortium et quelque peu adaptée par la suite, a mis en évidence l’hétérogénéité de la maladie.1 Ces sous-groupes présentent des différences en termes de biologie de la maladie, de réponse au traitement et de pronostic. Les sous-groupes sont les suivants:
-
POLE (ADN polymérase epsilon) ultramuté
-
Déficit de réparation des mésappariements de l’ADN (MMRd, DNA mismatch repair deficient)/instabilité microsatellitaire (MSI-H, high microsatellite instability)
-
p53 mutant
-
Pas de profil moléculaire spécifique (NSMP, no specific molecular profile)
La chimiothérapie (CTx) à base de carboplatine et de taxol est depuis de nombreuses années la norme dans le traitement de première ligne. Ce n’est qu’avec l’utilisation d’inhibiteurs de point de contrôle (IPC) que des progrès ont été réalisés chez au moins une partie des patient·es.
Dans cet aperçu, nous souhaitons résumer les options thérapeutiques actuelles dans le CE métastatique, répertorier les nouveaux développements et discuter des questions en suspens.
Inhibiteurs de point de contrôle dans le traitement de première ligne
Sur la base des résultats prometteurs des études sur l’immunothérapie (IO) dans les lignes de traitement ultérieures du CE métastatique ou récidivant, plusieurs études ont été menées ces dernières années sur l’association d’inhibiteurs de point de contrôle et d’une chimiothérapie par carboplatine et paclitaxel en première ligne de traitement du CE métastatique ou récidivant.2,3 Les résultats de quatre études de phaseIII ont été publiés ces deux dernières années.4–7
Les études avaient une méthodologie similaire. Les patient·es atteint·es d’un CE récidivant n’ayant pas encore été traité et les patient·es atteint·es d’un CE de stadeIII/IV nouvellement diagnostiqué sans possibilité/perspective de traitement curatif ont été inclus·es et randomisé·es. En plus de la chimiothérapie standard à base de carboplatine (AUC 5) et de paclitaxel (175mg/m2) toutes les trois semaines pour un total de six cycles, ils·elles ont reçu un inhibiteur de point de contrôle dans le bras sous traitement à l’étude et un placebo (Pb) dans le bras témoin, suivi d’un IPC ou d’un placebo en traitement d’entretien.
Outre l’utilisation de différents IPC, il existait d’autres différences entre les études. Les critères d’inclusion concernant les sous-types histologiques n’étaient pas les mêmes. Les patient·es atteint·es de carcinosarcome de l’endomètre pouvaient être inclus·es dans les études RUBY, AtTEnd et DUO-E, mais pas dans l’étude NRG-GY018. Une autre différence dans les critères d’inclusion était le délai entre la fin du traitement à visée curative et la survenue de la récidive (RUBY: 6 mois; NRG-GY018: 12 mois). De plus, la durée du traitement d’entretien variait d’une étude à l’autre.
Le critère d’évaluation primaire dans toutes les études était la survie sans progression (PFS, progression free survival). La population d’analyse des critères d’évaluation n’était pas définie de la même manière dans différentes études. Dans l’étude NRG-GY018, le critère d’évaluation primaire était évalué séparément dans le groupe MMRp («mismatch repair proficient») et dans le groupe MMRd («mismatch repair deficient»). En revanche, dans l’étude RUBY, la PFS était analysée dans la population porteuse de tumeurs MMRd/MSI-H et dans la population totale.
Toutes les études ont atteint le critère d’évaluation primaire de PFS. Chez les patient·es avec MMRd/MSI-H, les résultats sont impressionnants et cohérents. Chez les patient·es atteint·es de CE MMRp, le bénéfice d’une telle association est moins clair. Les CE MMRp/MSS (stabilité microsatellitaire) constituent un groupe hétérogène et il pourrait exister d’autres sous-groupes, non encore définis, pour lesquels il y a des différences en termes d’efficacité des IPC. Il est également possible que des différences d’efficacité entre les inhibiteurs de PD-1 et de PD-L1 soient observées dans le CE MMRp/MSS.
Depuis les présentations et la publication initiales, les données ont été présentées avec des suivis plus longs (FU) ainsi que différentes analyses de sous-groupes.
L’étude RUBY
L’étude RUBY (ENGOT-EN-6-NSGO/GOG-3031/RUBY) est une étude en deux parties évaluant, dans la première partie, l’importance de l’immunothérapie par dostarlimab et, dans la seconde partie, le rôle de l’association de dostarlimab et l’olaparib (inhibiteur de PARP, PARPi) en traitement d’entretien.4
Les résultats de la première partie de l’étude RUBY ont été publiés en 2023. Parmi les quatre études, la période d’observation la plus longue était celle de l’étude RUBY. Il y a eu 494 patient·es inclus·es et randomisé·es selon un rapport 1:1. Parmi eux·elles, 48% présentaient une maladie récidivante. La majorité des patient·es ayant reçu un premier diagnostic (33% de la population totale) présentaient un CE de stadeIV et environ 18%, de stadeIII. Environ 15% des patient·es atteint·es de CE récidivant inclus·es avaient reçu auparavant une CTx adjuvante. Pour ces patient·es, la récidive devait être survenue au moins six mois après la fin du traitement. Parmi les patient·es, 118 (près de 24%) présentaient un déficit de réparation des mésappariements ou un statut MSI-H. Le sous-type histologique le plus fréquent était l’adénocarcinome endométrioïde (55%), suivi du type séreux (20%) et du carcinosarcome (10%).
Les patient·es ont reçu six cycles de CTx toutes les trois semaines en association avec le dostarlimab (inhibiteur de PD-1, 500mg) ou avec un placebo. Le traitement d’entretien consistait ensuite en l’administration de dostarlimab (1000mg) ou d’un placebo toutes les six semaines pendant trois ans au maximum.
Les deux cocritères d’évaluation primaires – la PFS (dans la population totale et dans le groupe MMRd) et la survie globale (OS) – ont été atteints. Les résultats ont été publiés en 2023 dans le New England Journal of Medicine. Dans la population totale, le taux de PFS à 24 mois était de 36,1% (IC à 95%: 29,3–42,9) dans le bras sous dostarlimab et de 18,1% (IC à 95%: 13,0–23,9) dans le bras sous placebo, avec un HR de 0,64 (IC à 95%: 0,51–0,80; p<0,001). Le taux d’OS était de 71,3% vs 56,0% (HR: 0,64; IC à 95%: 0,46–0,87; p=0,0021). Dans la population MMRd/MSI-H, la maladie n’avait pas progressé après 24 mois chez 61,4% (IC à 95%: 46,3–73,4) des patient·es du bras sous dostarlimab et 15,7% (IC à 95%: 7,2–27,0) des patient·es du bras sous placebo, ce qui est hautement significatif avec un HR de 0,28 (IC à 95%: 0,16–0,50; p<0,001).
Lors du congrès ESMO Gynaecological Cancers en juin 2024, les résultats de la deuxième analyse intermédiaire ont été présentés, avec une période d’observation de 36,6 mois. Les résultats pour les deux critères d’évaluation primaires sont restés significatifs. L’OS médiane dans la population totale est de 44,6 mois (IC à 95%: 32,6–NE) dans le bras sous dostarlimab et de 28,2mois (IC à 95%: 22,1–35,6) dans le bras sous placebo (HR: 0,69; IC à 95%: 0,54–0,89; p=0,002). Dans la population MMRd, l’OS médiane n’a pas été atteinte dans le bras sous dostarlimab, tandis qu’elle est de 31,4 mois dans le bras sous placebo (20,3 mois à NR; HR: 0,32; IC à 95%: 0,17–0,63; p=0,0002). Il convient de noter qu’environ 40% des patient·es du bras témoin ont été traité·es par immunothérapie en cas de progression de la maladie.
L’étude NRG-GY018
L’étude NRG-GY018 était l’étude ayant porté sur le plus grand nombre de patient·es (n=816). Elle comprenait également des patient·es atteint·es de CE de stadeIII/IVA avec maladie mesurable ou encore de stadeIVB ou récidivant avec ou sans maladie mesurable, dont 225 avaient un statut MMRd et 591, un statut MMRp.5 Les patient·es ont reçu du pembrolizumab (200mg q3w) ou un placebo en association avec une CTx pendant six cycles, puis un traitement d’entretien par pembrolizumab (400mg) ou placebo pendant un maximum de 14 cycles toutes les six semaines. Chez les patient·es présentant une maladie récidivante et ayant déjà reçu une chimiothérapie adjuvante, l’intervalle sans traitement devait être d’au moins douze mois après la fin du traitement. Une autre différence par rapport à l’étude RUBY était que les patient·es atteint·es de carcinosarcome étaient exclu·es. La durée médiane d’observation était de 12 mois pour la cohorte MMRd et de 7,9 mois pour la cohorte MMRp.
Le critère d’évaluation primaire de PFS a été analysé séparément pour les groupes MMRd et MMRp et il était significativement prolongé dans les deux groupes. Dans la cohorte MMRd, 74% des patient·es du bras sous pembrolizumab étaient exempt·es de progression à douze mois, vs 38% des patient·es du bras sous placebo. Le critère d’évaluation de PFS n’a pas été atteint dans le bras sous pembrolizumab de la cohorte dMMR et était de 7,6 mois dans le bras sous placebo, ce qui est hautement significatif, avec un HR de 0,30 (IC à 95%: 0,19–0,48) et un p<0,001.
Dans la cohorte MMRp, l’allongement a été nettement moins important, mais statistiquement significatif: la PFS médiane (mPFS) a été de 13,1 mois dans le bras sous pembrolizumab vs 8,7 mois dans le bras témoin (HR: 0,54; IC à 95%: 0,4–0,71; p<0,001). Les données relatives à la survie globale ne sont pas encore mûres à l’heure actuelle.
L’étude AtTEnd/eNGOT-en7
L’étude AtTEnd/eNGOT-en7 a porté sur 551 patient·es atteint·es de CE de stadeIII/IV récemment diagnostiqué ou récidivant, randomisé·es selon un rapport 2:1 pour recevoir l’atézolizumab (inhibiteur de PD-1, 1200mg), ou un placebo en association avec la CTx pendant six à huit cycles. Le traitement d’entretien par atézolizumab ou placebo administré ensuite pouvait être poursuivi jusqu’à la progression de la maladie.7
Les résultats pour la population MMRd sont comparables à ceux des deux études déjà mentionnées: après un FU médian de 28,3 mois, la PFS n’a pas été atteinte dans le bras sous atézolizumab («not estimable» [NE]) et était de 6,9 mois dans le bras sous placebo, ce qui est significatif, avec un HR de 0,36 (IC à 95%: 0,23–0,57) et un p=0,0005. Cependant, aucune amélioration de la PFS n’a été observée dans le groupe MMRp/MSS: 9,5 mois dans le bras sous atézolizumab vs 9,2 mois dans le bras sous placebo (HR: 0,92; IC à 95%: 0,73–1,16; p=38). Dans l’ensemble de la population, l’ajout de l’atézolizumab a également permis de prolonger la PFS (PFS: 10,1 vs 8,9 mois; HR: 0,74; IC à 95%: 0,61–0,91; p=0,022).
En ce qui concerne la survie globale, une tendance a été observée, mais pas d’allongement statistique (38,7 mois vs 30,2 mois; HR: 0,82; IC à 95%: 0,63–1,07; p=0,0483), qui peut être attribué au bénéfice dans le groupe MMRd.
L’étude DUO-E/GOG-3041/ENGOT-EN10
L’étudeDUO-E/GOG-3041/ENGOT-EN10 était une étude randomisée à trois bras évaluant l’association d’une chimiothérapie et du durvalumab (inhibiteur de PD-L1, 1120mg q3w) ou d’un placebo, suivie d’un traitement d’entretien par placebo ou par durvalumab en association avec l’olaparib (inhibiteur de PARP) ou un placebo.6
Il y a eu 699 patient·es atteint·es de CE primaire nouvellement diagnostiqué métastatique/localement avancé ou en première récidive inclus·es. Le critère d’évaluation primaire était la PFS pour l’ensemble de la population. Chacun des deux bras interventionnels (B et C) a été comparé à un bras témoin (A). La randomisation a été effectuée selon un rapport 1:1:1.
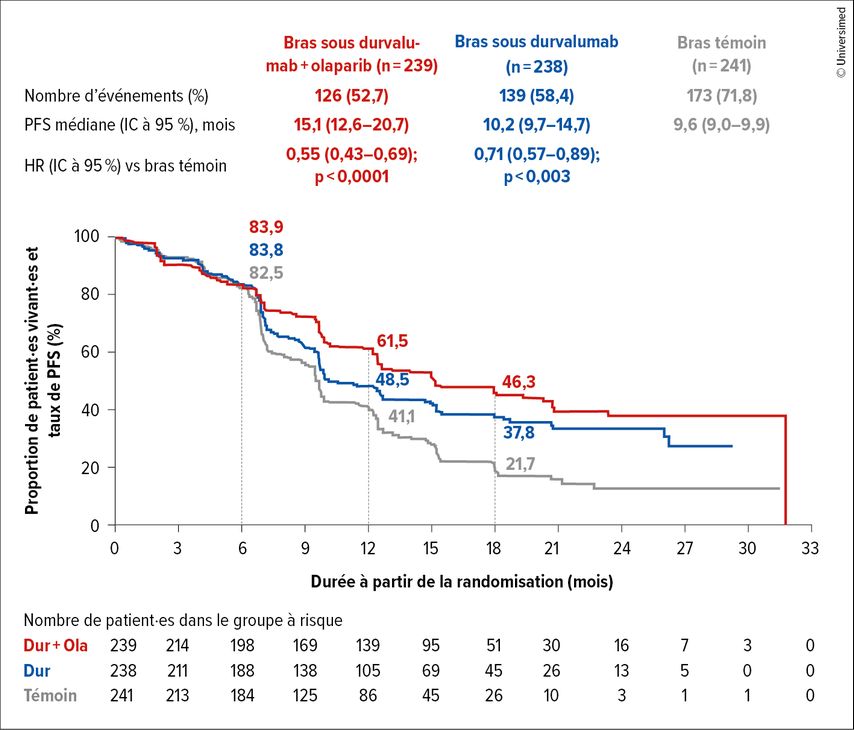
Dans le bras témoin A, les patient·es ont reçu une chimiothérapie et un placebo, suivis d’un placebo. Dans le bras B, ils·elles ont reçu la même CTx avec du durvalumab (1120mg toutes les trois semaines), suivi d’un traitement d’entretien par durvalumab (1500mg q4w). Dans le bras C, la partie chimiothérapie/durvalumab était la même que dans le bras B. Dans la phase d’entretien, les patient·es ont reçu en association l’olaparib (300mg deux fois par jour) et le durvalumab. Le critère d’évaluation primaire était la PFS (Fig.1).
Fig.1: Critère d’évaluation primaire de la survie sans progression (PFS) dans l’étude DUO-E/GOG-3041/ENGOT-EN10 (modifiéeselon Westin SN et al.)6
Les résultats montrent une prolongation de la PFS dans les deux bras interventionnels. Dans le bras B, la PFS était de 10,2 mois vs 9,6 mois dans le bras témoin (HR: 0,71; IC à 95%: 0,57–0,89; p=0,003). Dans le bras C, la PFS était de 15,1 mois (HR: 0,55; IC à 95%: 0,43–0,69; p<0001). Ainsi, tant l’association de chimiothérapie et de durvalumab suivie d’un traitement d’entretien par durvalumab que l’association de chimiothérapie et de durvalumab suivie d’un traitement d’entretien par durvalumab et olaparib améliorent les résultats par rapport au bras témoin. Une comparaison entre les bras B et C n’est pas prévue dans le plan de l’étude.
Méta-analyse et résumé
Une méta-analyse a évalué les données cumulées de 2320 patient·es inclus·es dans les quatre études mentionnées.9 Les résultats confirment l’allongement de la PFS pour l’ensemble de la population avec l’association d’une immunothérapie et d’une chimiothérapie par rapport à la chimiothérapie combinée à un placebo (HR 0,70; IC à 95%: 0,62–0,79) et en particulier pour les patient·es atteint·es de MMRd/MSI-H (n=563; HR: 0,334; IC à 95%: 0,2–0,434). Un avantage a également été observé chez les patient·es atteint·es de CE MMRp/MSS (n=1757; HR: 0,74; IC à 95%: 0,60–0,91).
En ce qui concerne l’OS, les résultats de la méta-analyse ont montré une amélioration pour l’ensemble de la population (HR: 0,75; IC à 95%: 0,63–0,89), bien que les données de survie globale dans l’ensemble des quatre études ne soient pas encore mûres.9
L’association d’IPC (PD-1 et PD-L1) et de la CTx, suivie du traitement d’entretien par IPC, améliore donc considérablement et systématiquement le pronostic des patient·es atteint·es de CE MMRd/MSI-H. Chez les patient·es atteint·es de CE MMRp/MSS, il existe également un avantage, mais l’interprétation des données est plus complexe et la question de savoir quel·les patient·es atteint·es de ce sous-type bénéficient réellement de l’immunothérapie n’est pas encore résolue.
Comme mentionné précédemment, dans l’étude NRG-GY018, le bénéfice en termes de PFS dans le groupe MMRp était statistiquement significatif (HR: 0,54; IC à 95%: 0,41–0,71; p<00001) et, avec cinq mois de différence dans la mPFS, également cliniquement pertinent. Une analyse du sous-groupe MMRp dans l’étude RUBY n’était pas prévue comme critère d’évaluation primaire, mais comme analyse exploratoire planifiée, et montre un HR de 0,76 (0,59–0,98) avec une différence de mPFS de deux mois. Des données également présentées, mais non publiées, ont montré une différence d’OS médiane (mOS) de sept mois (bras sous dostarlimab: mOS 34,0 mois [28,6–NE] vs bras sous placebo: mOS 27,0 mois [21,5–35,6]; HR: 0,79 [IC à 95%: 0,60–1,04]; p=0,0493). En revanche, dans l’étude AtTEnd, l’ajout de l’atézolizumab n’a pas prolongé la PFS dans le groupe MMRp (9,5 vs 9,2 mois; HR: 0,92; IC à 95%: 0,73–1,16; p=0,38).
Une analyse exploratoire planifiée dans le groupe MMRp de l’étude DUO-E, présentée au congrès ESMO 2023, a montré une mPFS de 15 mois dans le bras sous CTx, durvalumab et olaparib, et une mPFS de 9,9 mois dans le bras sous CTx et durvalumab. Dans le bras placebo, elle était de 9,7 mois.8
Une analyse de sous-groupe de la première partie de l’étude RUBY selon les sous-types moléculaires, présentée à plusieurs reprises, a montré un bénéfice chez les patient·es présentant une mutation du gène p53 (taux de PFS à 24 mois: 32,4% vs 17,8%; HR: 0,55; IC à 95%: 0,30–0,99). En revanche, les patient·es du sous-groupe NSMP n’en ont pas bénéficié (taux de PFS: 31% vs 20,1%; HR: 0,77; IC à 95%: 0,55–1,07).10 Ainsi, malgré l’amélioration du pronostic, le besoin urgent de nouveaux traitements plus efficaces ou de nouvelles combinaisons demeure pour une partie des patient·es.
Les études en cours testent à la fois des nouveaux médicaments, principalement des conjugués anticorps-médicament (ADC), et différentes combinaisons de médicaments connus.
Combinaisons d’IPC avec d’autres médicaments
Inhibiteurs de PARP
La partie 2 de l’étude RUBY et le bras C de l’étude DUO-E, déjà présentés, évaluent l’association d’un IPC et d’inhibiteurs de PARP en traitement d’entretien.
Dans la deuxième partie de l’étude RUBY, après six cycles de carboplatine/paclitaxel avec dostarlimab ou placebo, les patient·es ont reçu un traitement d’entretien soit par dostarlimab et niraparib, soit par placebo. Les critères d’évaluation primaires sont la PFS dans la population totale et – contrairement à la partie 1 – la PFS dans le groupe MMRp/MSS. Les résultats présentés au congrès 2024 de la SSO par le Prof. Dr méd. Mirza, qui n’ont pas encore été publiés, montrent un avantage pour le dostarlimab et le niraparib en traitement d’entretien par rapport au placebo dans l’ensemble de la population et dans le groupe MMRp. Dans le bras sous dostarlimab et niraparib, la mPFS est de 14,3 mois dans le groupe MMRp et de 8,3 mois dans le bras placebo (HR: 0,63; IC à 95%: 0,44–0,91; p=0,0060). Le niraparib seul en traitement d’entretien n’ayant pas été testé dans cette étude, il n’est pas possible de déterminer le bénéfice exact apporté par le PARPi à partir de ces résultats (Fig.2).11
Fig.2: Critère d’évaluation primaire de la survie sans progression (PFS) dans la partie 2 de l’étude RUBY (modifiéeselon Mirza MR et al.)11
Dans le bras C de l’étude DUO-E, les patient·es ont reçu un traitement d’entretien par durvalumab+olaparib après six cycles de durvalumab+chimiothérapie. L’analyse exploratoire de sous-groupe prévue pour le groupe MMRp a révélé des résultats intéressants. La mPFS était de 9,7 mois dans le bras témoin et de 9,9 mois dans le bras sous CTx et durvalumab (HR: 0,77; IC à 95%: 0,60–0,97). Dans le bras C sous CTx, durvalumab et olaparib, la mPFS était nettement plus longue, à 15 mois (HR: 0,57; IC à 95%: 0,44–0,99).6
Inhibiteurs de tyrosine kinase
L’étude ENGOT-En9/LEAP-001 est une étude de phaseIII qui évaluait l’association de lenvatinib et de pembrolizumab dans le traitement de première ligne du CE métastatique ou récidivant. Dans la population MMRp, ni la PFS ni l’OS n’ont pu être prolongées. Les résultats ont été présentés au congrès ESMO 202412 et leur publication est attendue.
L’association de pembrolizumab et de lenvatinib reste donc une option en deuxième ligne pour les patient·es qui n’ont pas reçu d’IPC en première ligne.13
Conjugués anticorps/principe actif
Les cellules du cancer de l’endomètre expriment différents récepteurs contre lesquels sont dirigés plusieurs ADC déjà établis en partie dans d’autres entités, par exemple HER2, TROP-2, le récepteur alpha du folate ou B7-H4. Plusieurs études de phaseI/II recrutent déjà.
ADC ciblant HER2
HER2 est fréquemment exprimé dans le CE, en particulier dans les sous-types histologiques plus rares, comme le CE séreux et le CE à cellules claires. Dans le sous-type le plus courant, le CE endométrioïde, la surexpression de HER2+ est très rare.14 Les taux de réponse dans les études portant sur différents ADC ciblant HER2 sont de l’ordre de 58% pour l’ensemble des patient·es et peuvent atteindre 85% en cas d’expression de HER2+ de 3+. Les taux de PFS et d’OS sont également élevés.
L’étude DESTINY-PanTumor02 est une étude de phaseII dans laquelle des patient·es atteint·es de diverses tumeurs métastatiques prétraitées avec expression d’HER2 IHC 2+ ou IHC 3+ ont reçu le trastuzumab déruxtécan (5,4mg/kg toutes les trois semaines). Outre trois cohortes de tumeurs gynécologiques, l’étude s’est également penchée sur les cancers du pancréas, les cancers urothéliaux, les cholangiocarcinomes ainsi qu’une cohorte d’autres tumeurs plus rares. Le critère d’évaluation primaire est le taux de réponse global (ORR). Les critères d’évaluation secondaires étaient la durée de la réponse (DoR, duration of response), la PFS, l’OS et la sécurité. Dans la cohorte de CE, 40 patient·es ont été inclus·es, dont 24 (60%) avec une expression d’HER2 IHC 2+ et 16 (40%), IHC 3+.
L’ORR était de 57,5% dans la population totale et de 84% chez les patient·es avec une expression d’HER2 3+ et de 47% chez les patient·es avec une expression d’HER2 2+. Une étude de phaseIII est en préparation.15
Le BNT323/DB-1303, un autre ADC ciblant HER2, est étudié dans différentes cohortes dans le cadre d’une étude de phaseI/II non encore publiée. Chez les patient·es atteint·es de CE métastatique avec une expression d’HER2+ 3+, 2+ ou 1+, les résultats présentés au congrès ESGO 2024 étaient prometteurs. De bons taux de réponse ont été observés, en particulier pour le CE séreux. La FDA a accordé la désignation de médicament révolutionnaire. Une étude de phaseIII est également en préparation dans ce cadre.
ADC ciblant TROP-2
TROP-2 est également fréquemment exprimé dans le CE, en particulier dans le sous-type endométrioïde (60%), suivi du type séreux (40%) et également dans les carcinosarcomes (30%), comme l’a rapporté la Prof. Dre méd. Kathleen Moore dans sa présentation au congrès ESMO 2024. Le sacituzumab govitécan (SG) est l’ADC ciblant TROP-2 le plus étudié à ce jour. Des études sont également en cours sur le sacituzumab tirumotécan (Sac-TMT) et le datopotamab déruxtécan (Dato-DXd). Pour les trois substances, les composés cytotoxiques sont différents dérivés de la topoisomérase 1.
L’étude de phaseIII TROPiCS-03 est une étude panier évaluant le SG chez des patient·es atteint·es de différentes tumeurs métastatiques. Les données de la cohorte atteinte de CE ont été publiées en juillet 2024 dans le Journal of Clinical Oncology.16 La population de patient·es était soumise à un prétraitement intensif et a été traitée par SG à raison de 10mg/kg aux jours 1 et8.
Après une période d’observation médiane de 5,8 mois (0,7–19,3), le taux de réponse global était de 22% (IC à 95%: 11–38). Le taux de bénéfice clinique (CBR=CR+PR+SD) était de 32% (IC à 95%: 18–49%) et la DoR médiane (mDoR) était de 8,8 mois (IC à 95%: 2,8 à «non estimable»). La mPFS était de 4,8 mois (IC à 95%: 2,8–9,8). Une corrélation entre l’expression de TROP-2 et la réponse n’a pas été démontrée. On a relevé un TRAE de grade3 chez 73% des patient·es. Les données présentées lors de la séance d’affiches du congrès ESMO 2024, avec un suivi plus long, ont montré un ORR de 27%, un CBR de 42%, une mDoR de neuf mois (82,8–NR) et une mPFS de cinq mois (2,8–9,8).17
Dans l’étude TROPION-PanTumor03, 40 patient·es atteint·es de CE métastatique ou avancé ont été traité·es par Dato-DXd. Les résultats pour le cancer de l’ovaire (CO) et le CE ont été présentés par la Prof. Dre méd. Ana Oaknin au congrès ESMO 2024. Dans la cohorte atteinte de CE, l’ORR de 27,5% était comparable au résultat de l’étude TROPiCS-03. La mDoR était de 16,5 mois et la mPFS, de 6,3 mois. Les effets secondaires les plus fréquents étaient la stomatite et les nausées.18
Des données sur le Sac-TMT ont également été présentées lors du congrès ESMO 2024; elles ont montré un ORR comparable (27,3%). La signification de l’expression de TROP-2 sur les cellules tumorales n’est actuellement pas encore élucidée.19
Récepteur alpha anti-folate
Le mirvétuximab soravtansine (MIRV) est un ADC dirigé contre le récepteur alpha du folate qui a montré son efficacité dans plusieurs études sur le cancer de l’ovaire résistant au platine.20 Le MIRV est étudié dans certaines études sur le CE en monothérapie ou en association avec d’autres substances (IPC ou PARPi).
Une étude de phaseII sur le CE MSS évalue l’association mirvétuximab+pembrolizumab. L’expression du récepteur alpha du folate a été étudiée dans 130 tumeurs. Une expression ≥50% a été observée dans 33% des tumeurs. Il y a eu 16 patient·es traité·es, le taux d’échec était de 37,5%. Les effets secondaires les plus fréquents étaient des augmentations des taux d’ASAT ainsi que des troubles de la vision, de la fatigue et de la diarrhée. Les données ont été présentées au Congrès AACR 2024.21
Autres substances
ENGOT-EN5/GOG-3055/SIENDO est une étude randomisée de phaseIII dans laquelle 263 patient·es ayant répondu à une chimiothérapie par carboplatine et paclitaxel ont été randomisé·es pour recevoir un traitement d’entretien par sélinexor ou placebo. Une prolongation de la PFS a été rapportée dans le groupe prédéfini de patient·es affichant la mutation TP53.22
Résumé
L’association d’IPC et de CTx est la nouvelle norme dans les cancers de l’endomètre MMRd/MSI-H. Dans le cas du CE MMRp/MSS, les données disponibles jusqu’à présent montrent une certaine efficacité, en particulier des inhibiteurs de PD-1, chez une partie des patient·es. La FDA et l’EMA ont toutes deux approuvé l’association de CTx et de dostarlimab ou de pembrolizumab chez l’ensemble des patient·es atteint·es de CE métastatique/récidivant, indépendamment du statut MMR. L’EMA a approuvé l’association de durvalumab et de CTx suivie de durvalumab dans le CE MMRd ou de durvalumab et d’olaparib dans le CE MMRp.
Le besoin de développer de nouvelles combinaisons et/ou de nouveaux médicaments est important. Les données actuelles des études précoces sur les ADC laissent espérer que ces médicaments permettront d’améliorer le pronostic.
À l’heure actuelle (octobre 2024), il n’existe pas d’autorisation de mise sur le marché en Suisse pour l’association de l’immunothérapie et de la CTx dans le traitement de première ligne du cancer de l’endomètre métastatique ou récidivant.
Littérature:
1 Cancer Genome Atlas Research Network, Kandoth C et al.: Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497(7447): 67-73 2 O’Malley DM et al.: Pembrolizumab in patients with microsatellite instability-high advanced endometrial cancer: results from the KEYNOTE-158 study. J Clin Oncol 2022; 40(7): doi.org/10.1200/JCO.21.01874 3 Oaknin A et al.: Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite instability-high (dMMR/MSI-H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET-a phase I, single-arm study. J Immunother Cancer 2022; 10: e003777 4 Mirza MR et al.: Dostarlimab for primary advanced or recurrent endometrial cancer. NEngl J Med 2023; 388(23): 2145-58 5 Eskander RN et al.: Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023; 388(23): 2159-70 6 Westin SN et al.: Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: the phase III DUO-E trial. J Clin Oncol 2024; 42(3): 283-99 7 Colombo N et al.: Atezolizumab and chemotherapy for advanced or recurrent endometrial cancer (AtTEnd): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2024; 25(9): 1135-46 8 Westin SN et al.: Durvalumab (durva) plus carboplatin/paclitaxel (CP) followed by maintenance (mtx) durva ± olaparib (ola) as a first-line (1L) treatment for newly diagnosed advanced or recurrent endometrial cancer (EC): results from the phase III DUO-E/GOG-3041/ENGOT-EN10 trial. ESMO 2023; Abstr. #LBA41 9 Bogani G et al.: Adding immunotherapy to first-line treatment of advanced and metastatic endometrial cancer. Ann Oncol 2024; 35 (5): 414-28 10 Mirza MR et al.: Dostarlimab + chemotherapy for the treatment of primary advanced or recurrent endometrial cancer (pA/rEC): analysis of progression free survival (PFS) and overall survival (OS) outcomes by molecular classification in the ENGOT-EN6-NSGO/GOG-3031/RUBY trial. ESMO 2024; Abstr. #740MO 11 Mirza MR et al.: Progression-free survival (PFS) in primary advanced or recurrent endometrial cancer (pA/rEC) in the overall and mismatch repair proficient (MMR/MSS) populations and in histological and molecular subgroups: results from part 2 of the RUBY trial. ESMO Open 2024; 9(Suppl. 5): 103538 12 Pignata S et al.: Phase III ENGOT-En9/LEAP-001 study: Lenvatinib + pembrolizumab (LEN/PEMBRO) vs chemotherapy (chemo) as first-line (1L) therapy for advanced or recurrent endometrial cancer. ESMO 2024; Abstr. #39MO 13 Makker V et al.: Lenvatinib plus pembrolizumab in previously treated advanced endometrial cancer: updated efficacy and safety from the randomized phase III study 309/KEYNOTE-775. JClin Oncol 2023; 41 (16): 2904-10 14 Nakajima J et al.: Therapeutic indications for antibody-drug conjugates estimated from HER2 and p53 expressions in endometrial carcinoma. Hum Pathol 2024; 152: 105649 15 Meric-Bernstam F et al.: Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. J Clin Oncol 2024; 42(1): 47-58 16 Santin AD et al.: Efficacy and safety of sacituzumab govitecan in patients with advanced solid tumors (TROPiCS-03): analysis in patients with advanced endometrial cancer. J Clin Oncol 2024; 42: 29 17 Corr PR et al.: Efficacy and safety of sacituzumab govitecan (SG) in patients with advanced/metastatic endometrial cancer (EC): updated results from TROPiCS-03. ESMO 2024; Poster #733P 18 Oaknin A et al.: Datopotamab deruxtecan (Dato-DXd) in patients with endometrial (EC) or ovarian cancer (OC): results from the phase II TROPION-PanTumor03 study. ESMO 2024; Abstr. #714MO 19 Wang D et al.: Safety and efficacy of sacituzumab tirumotecan (sac-TMT) in patients (pts) with previously treated advanced endometrial carcinoma (EC) and ovarian cancer (OC) from a phase II study. ESMO 2024; Abstr. #715MO 20 Moore KN et al.: Mirvetuximab soravtansine in FRα-positive, platinum-resistant ovarian cancer. N Engl J Med 2023; 389(23): 2162-74 21 Porter RL et al.: A phase 2, two-stage study of mirvetuximab soravtansine (IMGN853) in combination with pembrolizumab in patients with microsatellite stable (MSS) recurrent or persistent endometrial cancer. Cancer Res 2024; 84(Suppl.7): CT008 22 Makker V et al.: Long-term follow-up of efficacy and safety of selinexor maintenance treatment in patients with TP53wt advanced or recurrent endometrial cancer: a subgroup analysis of the ENGOT-EN5/GOG-3055/SIENDO study. Gynecol Oncol 2024; 185: 202-11
Das könnte Sie auch interessieren:
Intégration de nouveaux traitements dans le CPHSm et le CPRCm
Aujourd’hui, le cancer de la prostate est un exemple de maladie dont le traitement est hautement personnalisé et de longue durée, et pour laquelle des optimisations sont possibles en ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...