Intégration de nouveaux traitements dans le CPHSm et le CPRCm
Compte-rendu:
Dre méd. Judith Moser
Auteur:
Prof. Dr méd. Shahrokh F. Shariat
Universitätsklinik für Urologie, Medizinische Universität Wien
Comprehensive Cancer Center Vienna
Aujourd’hui, le cancer de la prostate est un exemple de maladie dont le traitement est hautement personnalisé et de longue durée, et pour laquelle des optimisations sont possibles en agissant sur différents leviers. Le défi consiste à combiner les «anciennes» et les «nouvelles» options dans le paysage du traitement multimodal pour obtenir des concepts optimaux.
L’objectif fondamental du traitement du cancer de la prostate (CP) est de rester le plus longtemps possible au stade hormonosensible avant l’apparition de la résistance à la castration. Dans le cas du CP hormonosensible métastatique (CPHSm), il ne fait désormais plus aucun doute que le seul traitement par privation androgénique (TPA) ne suffit pas. Selon l’Advanced Prostate Cancer Consensus Conference 2022, l’association de TPA et d’un ARPI (inhibiteurs de la voie de signalisation du récepteur des androgènes: abiratérone, enzalutamide, darolutamide, apalutamide) est considérée comme une stratégie thérapeutique de base établie dans le CPHSm, quelle que soit la catégorie pronostique.1
Parallèlement, le choix de TPA joue un rôle, bien que les preuves manquent dans ce domaine. À mon avis, les antagonistes de la GnRH devraient être préférés aux agonistes de la GnRH. Ils présentent l’avantage d’une suppression immédiate de la FSH, de la LH et de la testostérone, sans microsurtension, et sont associés à un risque moindre d’événements cardiovasculaires.2 Les patient·es présentant des antécédents cardiovasculaires et une charge tumorale symptomatique dans la région osseuse semblent particulièrement candidat·es aux antagonistes de la GnRH. Des bénéfices métaboliques peuvent également être obtenus en ajoutant de la metformine au traitement standard, comme le suggèrent les résultats générés dans le bras K de l’étude STAMPEDE.3
Association standard dans le CPHSm
Le choix de l’ARPI repose en premier lieu sur le profil de tolérabilité. Dernièrement, des données pertinentes concernant l’efficacité et la sécurité d’un traitement par ARPI ont pu être présentées au congrès ESMO 2024 avec l’étude randomisée de phaseIII en double aveugle ARANOTE.4
Dans l’étude ARANOTE, l’association de darolutamide et de TPA a entraîné une réduction de 46% du risque de progression radiologique ou de décès chez les patient·es atteint·es de CPHSm avec une maladie agressive, par rapport au placebo plus TPA. Il est intéressant de noter que ce bienfait était cohérent dans tous les sous-groupes, y compris ceux présentant un faible volume tumoral. De plus, le taux d’interruption du traitement en raison d’effets secondaires liés au traitement était comparativement plus faible dans le bras expérimental que dans le bras de contrôle (6,1% vs 9,0%); il a donc été possible de démontrer pour la première fois un avantage en faveur d’un nouveau traitement hormonal.
Chez des patient·es sélectionné·es en bonne santé et présentant une charge tumorale élevée, une intensification avec du docétaxel en plus du traitement de base par TPA/ARPI peut améliorer le pronostic, comme le montrent les données d’études. Par exemple, dans l’étude ARASENS, l’association de darolutamide, de TPA et de docétaxel a prolongé la survie globale (OS) par rapport au TPA associé au docétaxel, à la fois en cas de maladie de novo et de maladie récurrente.5 Les patient·es présentant un faible volume tumoral n’en ont toutefois pas bénéficié.6
Comme la toxicité est nettement augmentée à court terme par l’adjonction de docétaxel, une trithérapie ne s’impose que chez les personnes résistantes à la chimiothérapie et présentant une charge tumorale élevée, qui peuvent supporter une détérioration initiale de leur qualité de vie.1
Thérapie par radioligands et thérapie locale
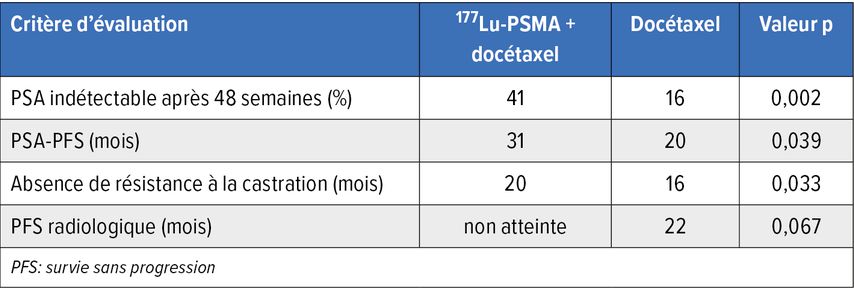
L’étude randomisée de phaseII UpFrontPSMA indique une place possible du traitement par 177Lu-PSMA-617 dans le CPHSm à volume tumoral élevé. Deux cycles de 177Lu-PSMA-617 suivis de six cycles de docétaxel ont permis d’obtenir des améliorations des résultats par rapport au docétaxel, sans augmentation de la toxicité globale, dans le sens d’une preuve de concept (Tab. 1).7
Tab.1: UpFront-PSMA: résultats sous 177Lu-PSMA-617 suivi de docétaxel vs docétaxel seul (modifié selon Azad AA et al.)7
Il ne faut pas oublier la thérapie locale de la tumeur primaire lorsque la charge tumorale est faible et que la réponse est bonne. Ce concept a une grande valeur compte tenu de l’interaction complexe entre la tumeur primaire et les métastases et du fait que la progression locale peut provoquer des troubles significatifs (p.ex. saignements, obstruction) même en cas de maladie stable.
Dans l’étude STAMPEDE, l’ajout de la radiothérapie au TPA a permis d’obtenir une prolongation de l’OS, mais uniquement en cas de faible volume tumoral.8 L’étude PEACE-1 laisse envisager des synergies possibles entre le TPA, l’ARPI et la radiothérapie chez les patient·es présentant un faible volume tumoral, mais il n’en résulte pas de prolongation de l’OS.9
Dans la pratique, l’ajout de la radiothérapie au traitement standard peut éventuellement s’appliquer dans le cadre d’un essai thérapeutique individuel avec tentative d’arrêt du traitement systémique après une certaine période. Pour la seule prévention de routine des complications locales, je ne recommande pas la radiothérapie dans le CPHSm.
CPRCm: Ra-223, inhibition de la PARP
Dans le cadre du CP résistant à la castration métastatique (CPRCm), il convient de mentionner l’étude de phaseIII randomisée et ouverte PEACE-3. L’enzalutamide et le radium 223 ont permis de prolonger la survie sans progression radiologique et d’autres critères d’évaluation par rapport à l’enzalutamide en monothérapie chez les patient·es asymptomatiques ou légèrement symptomatiques présentant des métastases osseuses.10 Dans ce groupe, l’enzalutamide/Ra223 et le dénosumab constituent une nouvelle option de première ligne si l’ARPI n’a pas encore été administré, ce qui n’est plus que rarement le cas.
La génétique joue un rôle de plus en plus important dans la prise en charge du CPRCm. Dans les études PROpel, TALAPRO-2 et MAGNITUDE, la combinaison d’ARPI et d’inhibiteurs de PARP s’est avérée être une puissante stratégie de première ligne, les bénéfices apparaissant principalement en présence de mutations BRCA/HRR.11–13
Afin d’amorcer rapidement le traitement, il est recommandé de procéder à une analyse génétique précoce chez tous les patient·es atteint·es de CPRCm. Tous·tes les patient·es présentant au moins une mutation BRCA1/2 devraient recevoir un inhibiteur de PARP. À l’avenir, la tâche consistera à identifier les séquences idéales des traitements disponibles pour le CPRCm.
Littérature:
1 Gillessen S et al.: Management of patients with advanced prostate cancer-metastatic and/or castration-resistant prostate cancer: report of the Advanced Prostate Cancer Consensus Conference (APCCC) 2022. Eur J Cancer 2023; 185: 178-215 2 Albertsen PC et al.: Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 2014; 65(3): 565-73 3 Gillessen S et al.: Adding metformin to androgen deprivation therapy for patients with metastatic hormone sensitive prostate cancer: overall survival results from the multi-arm, multi-stage randomised platform trial STAMPEDE. Ann Oncol 2024; 35(Suppl. 2): 1-72 4 Saad F et al.: Efficacy and safety of darolutamide plus androgen-deprivation therapy in patients with metastatic hormone-sensitive prostate cancer from the phase III ARANOTE trial. Ann Oncol 2024; 35(Suppl. 2): 1-72 5 Smith M et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022; 386(12): 1132-42 6 Hussain M et al.: Darolutamide plus androgen-deprivation therapy and docetaxel in metastatic hormone-sensitive prostate cancer by disease volume and risk subgroups in the phase III ARASENS trial. J Clin Oncol 2023; 41(20): 3595-607 7 Azad AA et al.: UpFrontPSMA: A randomised phase II study of sequential 177Lu-PSMA-617 and docetaxel versus docetaxel in metastatic hormone-sensitive prostate cancer. Ann Oncol 2024; 35(Suppl. 2): 1-72 8 Parker CC et al.: Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet 2018; 392(10162): 2353-66 9 Bossi A et al.: Prostate irradiation in men with de novo, low-volume, metastatic, castration-sensitive prostate cancer (mCSPC): results of PEACE-1, a phase 3 randomized trial with a 2x2 design. JClin Oncol 2023; 41(Suppl. 17): Abstr. #LBA5000 10 Gillessen S et al.: A randomized multicenter open label phase III trial comparing enzalutamide vs a combination of Radium-223 and enzalutamide in asymptomatic or mildly symptomatic patients with bone metastatic castration-resistant prostate cancer: first results of EORTC-GUCG 1333/PEACE-3. Ann Oncol 2024; 35(Suppl. 2): 1-72 11 Clarke NW et al.: Abiraterone and olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2022; 1(9): EVIDoa2200043 12Agarwal N et al.: Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 2023; 402(10398): 291-303 13 Chi KN et al.: Niraparib and abiraterone acetate for metastatic castration-resistant prostate cancer. J Clin Oncol 2023; 41(18): 3339-51
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...