Connaissances issues de la recherche fondamentale et de la pratique clinique
Compte-rendu:
Dre Judith Moser
Sous le slogan «Building Bridges in Coagulation», le 68e congrès annuel de la Gesellschaft für Thrombose und Hämostaseforschung (GTH; Société de recherche sur la thrombose et l’hémostase) s’est tenu à Vienne du 27 février au 1er mars 2024. De nouvelles données sur la physiopathologie et le traitement des cytopénies ainsi que le lien entre le traitement anticancéreux et la tendance à la thrombose ont notamment été discutés.
Hématopoïèse clonale: un facteur de risque cardiovasculaire
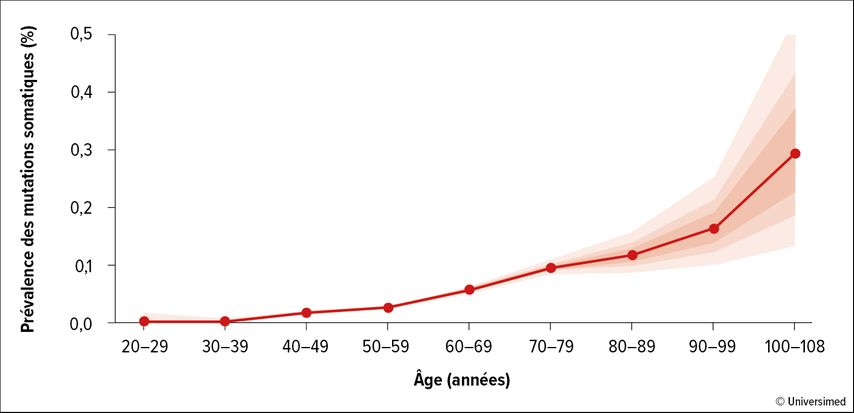
Avec l’âge, on observe une accumulation de mutations somatiques dans les cellules souches et progénitrices hématopoïétiques. À partir d’environ 40 ans, la prévalence des mutations augmente de plus en plus (Fig. 1).1 L’expansion clonale des cellules mutées a pour conséquence une hématopoïèse clonale (CH).2
Le professeur Dr José J. Fuster (Whitaker Cardiovascular Institute, Boston University School of Medicine, États-Unis) a souligné les conséquences de la CH induite par des mutations somatiques lors de la Keynote Lecture du congrès annuel de la GTH. Le risque de cancer hématologique est ainsi multiplié par dix, mais il existe également un lien avec des complications vasculaires liées à l’athérosclérose.3 En présence de mutations somatiques, l’incidence des maladies coronariennes est multipliée par 2 et celle des accidents ischémiques par 2,6.1 Cette corrélation a été établie indépendamment de l’âge, du sexe et des facteurs de risque cardiovasculaire conventionnels. De même, le «whole exome sequencing» a mis en évidence un lien entre la «clonal hematopoiesis of indeterminate potential» (CHIP) et l’apparition d’une artériopathie oblitérante périphérique chez plus de 50000 personnes.4 Des constatations définitives sur la chronologie des modifications font toutefois encore défaut, car les données épidémiologiques ne permettent pas de tirer des conclusions sur la causalité.
PESA
Le projet PESA (Progression of Early Subclinical Atherosclerosis) a été initié dès 2010 afin de clarifier la directionnalité du lien entre la CH et l’athérosclérose. Environ 4200 personnes ne présentant aucune maladie cardiovasculaire cliniquement manifeste et âgées de 40 à 54 ans ont été incluses dans cette étude à long terme.
Plus de 4000 paramètres sont enregistrés en relation avec les facteurs de risque cardiométabolique, le mode de vie, les marqueurs hématologiques et inflammatoires, ainsi que la longueur des télomères des leucocytes. Parallèlement, un test génétique complet (génomique, transcriptomique, protéomique, métabolomique, méthylomique) et un examen d’imagerie (échographie vasculaire, TDM, TEP/IRM au 18F-FDG) sont réalisés afin de détecter les modifications vasculaires, la fibrose et l’inflammation.
Comme l’a indiqué J. Fuster, environ 25% des personnes en bonne santé d’âge moyen sont déjà porteuses de mutations CH détectables, les mutations DNMT3A dominant.5 Selon les résultats obtenus jusqu’à présent, la CH influence l’athérosclérose, mais pas l’inverse. L’athérosclérose de novo dans les artères fémorales était significativement corrélée aux mutations CHIP avec une fréquence allélique de variants plus élevée, ainsi qu’aux mutations DNMT3A, TET2 et autres. En revanche, aucun effet de l’athérosclérose subclinique n’a été constaté sur la dynamique de la CH.
Dans l’ensemble, la CH induite par certaines mutations semble être un nouveau mécanisme pathogène pour les maladies athéroscléreuses et autres. Des recherches plus approfondies pourraient fournir une raison pour des thérapies ou des stratégies de prévention individuelles, adaptées à l’effet de mutations somatiques spécifiques.
Thromboses sous traitement oncologique: CAT-BLED
Par rapport à la population en bonne santé, les patient·es cancéreux·ses présentent un risque accru de thrombose, les thromboembolies veineuses (TEV) étant multipliées par 7 à 9 et les thromboembolies artérielles (TEA) par 2 à 3.6–8 Les chimiothérapies à base de platine, les agents anti-angiogéniques et les traitements endocriniens, entre autres, ont été identifiés comme facteurs de risque de TEV liée au cancer.9
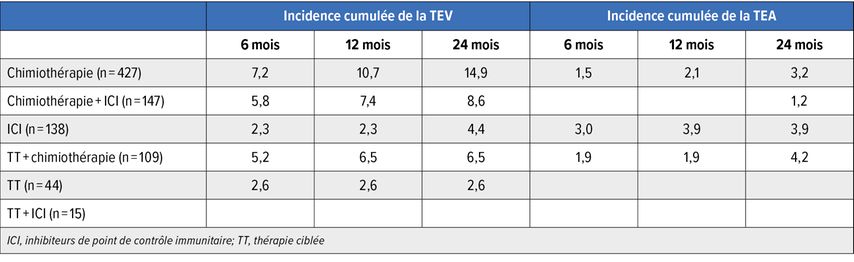
L’étude observationnelle prospective CAT-BLED (Vienna Cancer, Thrombosis and Bleeding Study), menée à l’Université de médecine de Vienne s’est concentrée sur l’incidence de la TEV et de la TEA chez 880 patient·es cancéreux·ses qui ont commencé un traitement oncologique systémique.10 48,5% étaient sous chimiothérapie, 16,7% sous chimiothérapie plus inhibiteurs de point de contrôle immunitaire (ICI), 15,7% sous ICI seuls et 12,4% sous chimiothérapie plus thérapie ciblée (TT). 5,0% étaient sous TT seule et 1,7% sous TT plus ICI. Un cancer métastatique était présent dans 62,6% des cas.
Tant l’incidence de la TEV que celle de la TEA étaient élevées dans l’étude, comme prévu: après douze mois, l’incidence cumulée s’élevait respectivement à 7,6% et 1,9%. Un lien avec le type de traitement a été mis en évidence. Les incidences de TEV les plus élevées ont été observées sous chimiothérapie et celles de TEA sous ICI ainsi que sous TT plus chimiothérapie (Tab. 1). Aucun événement n’est survenu sous TT plus ICI, mais il s’agissait du plus petit groupe. Selon l’analyse multivariée, les ICI étaient associés à un risque de TEV plus faible que les autres traitements (HR:0,60; NS), alors que la chimiothérapie est associée à un risque plus élevé (HR:2,46). La même corrélation a été observée pour la TEA, avec des valeurs HR de 0,52 et 1,17 (toutes deux non significatives).
Tab. 1: Incidence des thromboembolies veineuses (TEV) et artérielles (TEA) sous différents traitements anticancéreux (modifiée selon Englisch C. et al.)10
Les auteur·es ont conclu que le risque individuel de thrombose est influencé par le traitement anticancéreux. Des essais randomisés contrôlés ou un appariement basé sur la population seraient nécessaires pour mieux caractériser l’influence de certains traitements. Actuellement, le risque spécifique peut uniquement être évalué dans des sous-groupes de patients.
Modification de l’équilibre tPA/PAI-1 dans le PTI
Le purpura thrombopénique immunologique (PTI) primaire est dû à une réaction auto-immune contre les thrombocytes et les mégacaryocytes, qui entraîne une réduction du nombre de plaquettes jusqu’à <100x109/l. Sur le plan clinique, on constate non seulement une tendance accrue aux saignements, mais aussi une augmentation du risque thromboembolique. Les données sur la fibrinolyse en cas de PTI sont à ce jour limitées et controversées.
En supposant que l’état prothrombotique dans le PTI primaire est renforcé par une capacité fibrinolytique réduite, une étude de cohorte multicentrique prospective a examiné la formation et la dissolution de caillots, la formation de plasmine et les paramètres fibrinolytiques chez 86 patient·es adultes atteint·es de PTI primaire issu·es de la biobanque de Vienne sur le PTI. 43% ont reçu un traitement spécifique, composé principalement de corticoïdes et d’agonistes du récepteur de la TPO. 10,6% avaient déjà connu une thrombose auparavant. La comparaison a été effectuée avec 78 témoins en bonne santé issus de l’étude Vienna Bleeding Study. Schramm et al. ont présenté les résultats lors du congrès annuel de la GTH en 2024.11 Dans le groupe atteint de PTI, six personnes ont développé des thromboses, dont trois artérielles et trois veineuses. Comparé·es aux témoins sains, les patient·es atteint·es de PTI présentaient un retard dans la formation de caillots et de plasmine, une augmentation de l’absorption maximale de caillots, une augmentation de l’activité de l’inhibiteur de l’activateur du plasminogène de type 1 (PAI-1) et une diminution de l’activité de l’activateur tissulaire du plasminogène (tPA). Les taux du complexe tPA/PAI-1 étaient associés au temps de dissolution des caillots dans l’ensemble du groupe PTI et étaient plus élevés dans le sous-groupe qui a connu des thromboses.
Comme l’ont souligné les auteur·es, le tPA lié est dégradé plus lentement que le tPA actif dans les complexes. Outre l’activation chronique des cellules endothéliales, l’activation continue et le dysfonctionnement plaquettaire devraient contribuer aux complications thrombotiques.
PTT: avantages de la prophylaxie pendant la grossesse
Depuis la première description du purpura thrombotique thrombocytopénique (PTT), une maladie rare mais potentiellement mortelle, en 1924, la clarification de sa physiopathologie a permis de nouvelles approches diagnostiques et thérapeutiques. Le tableau clinique comprend une thrombocytopénie sévère, une anémie hémolytique, des thromboses microvasculaires disséminées et une ischémie organique avec des lésions de gravité variable.
Au début des années 2000, l’accumulation de multimères du facteur de von Willebrand (vWF) de haut poids moléculaire due à l’absence ou à l’inactivation de la métalloprotéase ADAMTS13 clivant le vWF a été identifiée comme le mécanisme pathologique central.12 Les anticorps ADAMTS13 déterminent la forme acquise à médiation immunitaire (PTTi), alors que les mutations du gène ADAMTS13 déterminent la forme congénitale (PTTc).13,14
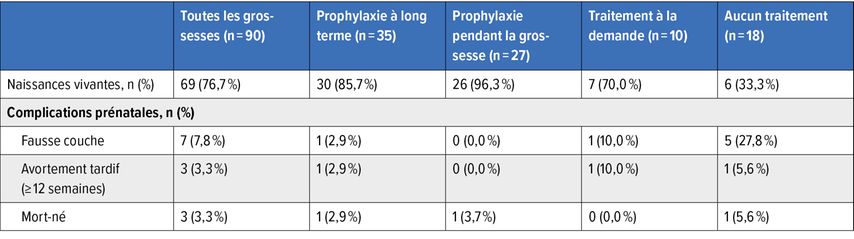
Schraner et al. ont présenté au congrès de la GTH leur étude observationnelle sur les résultats cliniques chez les femmes enceintes atteintes de PTTc.15 Sur la base de données issues de registres internationaux, des patientes ont été recensées, dont certaines étaient tombées enceintes avant que leur PTTc ne soit connu et d’autres seulement après. Les échanges plasmatiques constituent le traitement de première ligne, les directives recommandant un traitement prophylactique pendant la grossesse.16 Il a été démontré que la prophylaxie par échange plasmatique améliorait la morbidité maternelle et augmentait considérablement le taux de naissances vivantes (Tab. 2). Malgré l’augmentation du risque de pré-éclampsie en cas de PTTc, le taux de prescription d’acide acétylsalicylique (AAS) était faible dans le registre.
Tab. 2: Femmes enceintes atteintes de PTT: résultats selon la stratégie thérapeutique (modifié selon Schraner M. et al.)15
Les auteur·es recommandent la sensibilisation, la prophylaxie et la prescription d’AAS en temps opportun afin d’améliorer la prise en charge des patientes enceintes atteintes de PTTc.
Vers un traitement sans EPT
Après que l’échange plasmatique thérapeutique (ETP) ait été considéré pendant longtemps comme le seul traitement du PTT, un changement de paradigme a eu lieu dans ce nouveau millénaire. Dans le cas du PTTi, le caplacizumab, un nanobody dirigé contre le domaine A1 du vWF, a été mis à disposition en association avec une immunosuppression; dans le cas du PTTc, on utilise des échanges plasmatiques sans immunosuppression.17
Le concentré recombinant ADAMTS13, déjà autorisé aux États-Unis pour le traitement du PTTc, constitue une nouvelle étape. Après un diagnostic rapide, les stratégies actuelles permettent désormais de contrôler efficacement les poussées aiguës de PTT; le défi consiste désormais en premier lieu à obtenir des rémissions ADAMTS13 durables afin de prévenir les récidives.
Les études actuelles évaluent une approche thérapeutique sans EPT, lequel présente des risques. Kühne et al. ont présenté une étude de cohorte rétrospective basée sur l’Austrian Thrombotic Microangiopathy Registry et le German REACT-2020 TTP Registry à ce sujet.18 L’analyse a comparé les résultats chez les patient·es atteint·es de PTTi traité·es par EPT (59 épisodes) ou non (42 épisodes). En effet, l’association caplacizumab+immunosuppression seule s’est avérée être une stratégie efficace et sûre, permettant d’obtenir une réponse clinique ainsi que des rémissions ADAMTS13.
Par rapport au groupe traité par EPT, il en résulte un délai comparable jusqu’à la normalisation du nombre de plaquettes (3par rapport à 4 jours). Aucune différence n’a en outre été observée entre les groupes en ce qui concerne les critères d’évaluation secondaires, tels que le nombre d’épisodes avec une réponse clinique et la proportion de patient·es réfractaires.
Toutefois, l’abandon de l’EPT suppose des conditions cadres favorables, parmi lesquelles des temps de réponse courts pour le test ADAMTS13, la disponibilité du caplacizumab sur place et des infrastructures de communication optimales. De plus, il convient d’effectuer des contrôles de l’hémogramme dans les heures qui suivent la première administration de caplacizumab et de mettre en place une surveillance continue de la nécessité d’un EPT supplémentaire.
Source:
Congrès annuel de la GTH, du 27 février au 1 mars 2024, Vienne
Littérature:
1 Jaiswal S et al.: Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014; 371(26): 2488-98 2 Fuster JJ, Walsh K: Somatic mutations and clonal hematopoiesis: unexpected potential new drivers of age-related cardiovascular disease. Circ Res 2018; 122(3): 523-32 3 Genovese G et al.: Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. New Engl J Med 2014; 371(26): 2477-87 4 Zekawat SM et al.: TP53- mediated clonal hematopoiesis confers increased risk for incident atherosclerotic disease. Nat Cardiovasc Res 2023; 2: 144-58 5 Unveröffentlichte Daten 6 Mulder FI et al.: Venous thromboembolism in cancer patients: a population-based cohort study. Blood 2021; 137(14): 1959-69 7 Grilz E et al.: Relative risk of arterial and venous thromboembolism in persons with cancer vs. persons without cancer-a nationwide analysis. Eur Heart J 2021; 42(23): 2299-307 8 Mulder FI et al.: Arterial thromboembolism in cancer patients: a danish population-based cohort study. JACC CardioOncol 2021; 3(2): 205-18 9 Ay C et al.: Cancer-associated venous thromboembolism: burden, mechanisms, and management. Thromb Haemost 2017; 117(2): 219-30 10 Englisch C et al.: GTH 2024; Abstr. #SOA-02-OC-04 11 Schramm T et al.: GTH 2024; Abstr. #SOA-09-OC-03 12 Fujikawa K et al.: Purification of human von Willebrand factor-cleaving protease and its identification as a new member of the metalloproteinase family. Blood 2001; 98(6): 1662-6 13 Tsai HM, Lian EC: Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. NEngl J Med 1998; 339(22): 1585-94 14 Levy GG et al.: Mutations in a member of the ADAMTS gene family cause thrombotic thrombocytopenic purpura. Nature 2001; 413(6855): 488-94 15 Schraner M et al.: GTH 2024; Abstr. #SOA-03-OC-06 16 Zheng XL et al.: ISTH guidelines for the diagnosis of thrombotic thrombocytopenic purpura. JThromb Haemost 2020; 18(10): 2486-95 17 Sukumar S et al.: Thrombotic thrombocytopenic purpura: pathophysiology, diagnosis, and management. JClin Med 2021; 10: 536 18 Kühne L et al.: GTH 2024; Abstr. #SOA-03-OC-04
Das könnte Sie auch interessieren:
Le symposium «ASCO Genitourinary Cancers Symposium» fête son 20e anniversaire
Avec 5200inscriptions et 877résumés soumis, le symposium «ASCO Genitourinary Cancers Symposium» (ASCO GU) a fêté son 20eanniversaire au début de cette année. DrEric Small, président lors ...
La sélection est essentielle dans le traitement des tumeurs gastro-intestinales
La différenciation moléculaire au sein des entités tumorales a conduit à de nouvelles options thérapeutiques, en particulier en ce qui concerne les stratégies thérapeutiques ciblées. L’ ...
Nouveaux traitements de référence, thérapies combinées et séquençage optimal
L’European Lung Cancer Congress (ELCC) s’est tenu à Prague du 20 au 23 mars. Cette année encore, l’accent a été principalement mis sur les immunothérapies et les thérapies ciblées. Ci- ...