La sélection est essentielle dans le traitement des tumeurs gastro-intestinales
Compte-rendu:
Dre Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La différenciation moléculaire au sein des entités tumorales a conduit à de nouvelles options thérapeutiques, en particulier en ce qui concerne les stratégies thérapeutiques ciblées. L’immunothérapie a également établi des biomarqueurs qui, avec la sélection des patient·es, augmentent les chances de succès. Lors du symposium ASCO sur les cancers gastro-intestinaux (ASCO GI) de cette année, des résultats thérapeutiques supérieurs ont en outre été démontrés avec l’association de traitements établis.
Grande efficacité du double immunitaire dans le CRCm MSI-H/dMMR
Les patient·es atteint·es de cancer colorectal métastatique (CRCm) et présentant une instabilité élevée des microsatellites (MSI-H) ou un défaut de réparation des mésappariements (dMMR) ont un mauvais pronostic avec une chimiothérapie standard, même en association avec un traitement ciblé. L’étude de phaseIII CheckMate 8HW a évalué le blocage immunitaire double par nivolumab, un anticorps abnti-PD-1, et par ipilimumab, un anticorps anti-CTLA4, chez des patient·es atteint·es de CRCm MSI-H/dMMR. Les premiers résultats ont été présentés lors de l’ASCO GI.1 L’étude à trois bras comparait selon un rapport 2:2:1 le nivolumab vs association nivolumab+ipilimumab vs chimiothérapie au choix du praticien. Dans le bras de chimiothérapie, 56 patient·es ont également reçu le bévacizumab et 10, le cétuximab. Les médicaments de l’étude étaient administrés jusqu’à la progression de la tumeur, l’apparition d’une toxicité intolérable ou une durée maximale de deux ans. Lors de l’ASCO GI, des résultats ont été présentés pour le traitement de première ligne comparant l’immunothérapie d’association et la chimiothérapie.
Les bras de l’étude évalués à l’ASCO GI comprenaient respectivement 202 et 101patient·es. L’âge médian était de 62 et 65ans, respectivement, et 58% vs 46% des personnes touchées avaient moins de 65ans. Parmi les patient·es, 42% vs 49% présentaient une maladie de stade IV et 68% vs 67% des tumeurs étaient des tumeurs primitives du côté droit. L’expression de PD-L1 était <1% chez 72% et 79% des patient·es, respectivement, et un BRAF/KRAS/NRAS de type sauvage a été détecté chez 23% des patient·es des deux bras de l’étude. Une résection de la tumeur a été réalisée chez 86% vs 83% des patient·es.
Un tiers vs 0% des patient·es ont terminé le traitement par nivolumab+ipilimumab ou la chimiothérapie. La durée médiane du traitement était de 13,5mois dans le bras sous immunothérapie vs 4,0mois dans le bras sous chimiothérapie. Le traitement a été interrompu chez 48% vs 93% des patient·es, 19% vs 69% en raison d’une progression de la maladie et 18% vs 5% en raison d’effets secondaires liés au traitement.
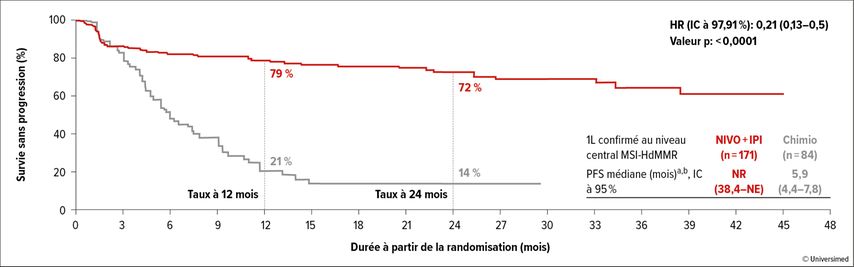
L’étude a atteint son premier critère d’évaluation principal double. La survie sans progression (PFS) médiane n’était pas encore atteinte dans le bras sous nivolumab+ipilimumab et était de 5,9mois dans le bras sous chimiothérapie. Le risque de progression était inférieur de 79% avec le double blocage immunitaire par rapport à la chimiothérapie (HR: 0,21; IC à 95%: 0,13–0,35; p<0,0001; Fig. 1).
Fig. 1: Survie sans progression (PFS) sous traitement de première ligne par nivolumab+ipilimumab (nivo+ipi) vs chimiothérapie (chimio) dans le CRCm MSI-H/dMMR (modifié d’après Thierry A et al.)1
Après 12mois, la maladie n’avait pas progressé chez 79% vs 21% des patient·es et chez 72% vs 14% après 24mois. Tous les sous-groupes étudiés ont montré une PFS significativement prolongée avec le double blocage immunitaire par rapport à la chimiothérapie. Le profil de sécurité était différent dans les deux bras de l’étude, mais dans l’ensemble, les effets secondaires de grade 3/4 associés au traitement étaient moins fréquents avec le schéma nivolumab+ipilimumab qu’avec la chimiothérapie.
Les résultats étayent l’utilisation du schéma nivolumab+ipilimumab comme traitement standard de première ligne chez les patient·es atteint·es de CRCm MSI-H/dMMR, concluent les auteur·es.
Cancer de l’œsophage: associations en traitement de première ligne
L’association d’inhibiteurs de points de contrôle et de chimiothérapie a déjà fait ses preuves en traitement de première ligne de traitement des patient·es atteint·es de cancer de l’œsophage. Les résultats de l’étude de phaseIII randomisée et contrôlée par placebo KEYNOTE-590 ont montré un avantage en termes de survie lorsque le pembrolizumab était administré en plus de la chimiothérapie. Lors de l’ASCO GI, les données à 5ans de l’étude ainsi qu’une évaluation de sous-groupe pour le carcinome épidermoïde de l’œsophage (CEO) ont été présentées.2
Pour la population en ITT (n=652), la PFS médiane était de 6,3mois vs 5,8mois (HR: 0,64; IC à 95%: 0,54–0,75). Après 60mois, 5,5% des patient·es étaient encore en vie sans progression, contre 0% des patient·es du bras placebo. La survie globale (OS) médiane était de 12,3mois vs 9,8mois (HR: 0,72; IC à 95%: 0,62–0,84), avec un taux de survie à 60mois de 10,6% vs 3,0%. Les résultats pour la population de patient·es atteint·es de CEO (n=548) étaient comparables à ceux de la population en ITT: la PFS médiane était de 6,3mois vs 5,8 (HR: 0,65; IC à 95%: 0,54–0,78) et l’OS, de 12,6mois vs 9,8 (HR: 0,71; IC à 95%: 0,60–0,85). Après 60mois, 6,7% vs 0% des patient·es étaient encore en vie sans progression et 11,8% vs 3,4% étaient encore en vie. Dans la population de patient·es atteint·es de CEO, 43,8% vs 31,0% des patient·es ont répondu au schéma pembrolizumab+chimiothérapie vs placebo+chimiothérapie, tandis que les patient·es présentant un CPS≥10 ont répondu dans 51,1% vs 28,0% des cas. La durée de la réponse était de 9,1mois vs 6,1mois (CEO) et de 10,4mois vs 4,4mois (CEO/CPS≥10).
De nouvelles données ont également été présentées à l’ASCO GI concernant le nivolumab, un inhibiteur de PD-1, dans le traitement de première ligne du CEO avancé.3 Au total, 970participant·es de l’étude de phaseIII à trois bras CheckMate648 ont reçu le schéma nivolumab+ipilimumab, le schéma nivolumab+chimiothérapie ou la chimiothérapie seule.
Une prolongation de l’OS par rapport à la chimiothérapie ainsi qu’un maintien de la qualité de vie ont été démontrés pour les deux bras de l’étude recevant le nivolumab. Dans une évaluation récente, la période ajustée en fonction de la qualité sans symptômes ni toxicité a été comparée («quality-adjusted time without symptoms and toxicity»; Q-TWiST). Pour ce faire, l’OS a été répartie en période pendant laquelle une toxicité a été observée, période entre la progression de la tumeur et le décès et période sans symptômes ni toxicité (TWiST). Une différence >1,1mois entre les trois groupes de qualité a été définie comme cliniquement significative.
Les patient·es du bras nivolumab+chimiothérapie ont présenté une période de toxicité légèrement plus longue (1,4mois) par rapport au bras nivolumab+ipilimumab (1,0mois) et à la chimiothérapie seule (0,9mois), mais aussi la TWiST la plus longue (8,0 vs 6,6 vs 5,8mois). Le délai entre la progression de la tumeur et le décès était de 7,5mois (nivolumab+chimiothérapie), 9,0mois (nivolumab+ipilimumab) et 7,3mois (chimiothérapie) dans les trois bras de l’étude. Avec une différence de 1,7 et 1,3mois respectivement, une différence pertinente de Q-TWiST a été observée entre nivolumab+chimiothérapie et nivolumab+ipilimumab par rapport à la chimiothérapie seule.
Traitement synergique avec un nouvel inhibiteur de point de contrôle dans le CEO
L’association tiragolumab+atézolizumab+chimiothérapie est une combinaison innovante dans le traitement du CEO.Le tiragolumab est un anticorps monoclonal qui se lie au récepteur TIGIT sur les lymphocytes T et les cellules tueuses naturelles, bloquant ainsi l’interaction immunosuppressive avec la protéine PVR. L’association immunitaire synergique avec l’atézolizumab a été évaluée dans l’étude de phaseIII randomisée, en double aveugle et contrôlée par placebo SKYSCRAPER-08 dans le traitement de première ligne du CEO.4 Les critères d’évaluation primaires étaient l’OS et la PFS. L’étude a porté sur 461patient·es asiatiques d’un âge médian de 63,0ans. Parmi les patient·es, 88 à 89% présentaient un statut PD-L1 positif (score TAP≥1%) et 20 à 23% présentaient des métastases hépatiques.
Les résultats finaux de l’OS confirment un avantage significatif pour l’association immunitaire par rapport à la chimiothérapie seule (HR: 0,70; IC à 95%: 0,55–0,88; p=0,0024). L’OS médiane était de 15,7mois vs 11,1mois, et 47,2% des patient·es étaient en vie à 18mois vs 33,8%. La PFS médiane était de 6,2mois vs 5,4mois, avec un taux de PFS à 12mois de 24,0% vs 6,1% (HR: 0,56; IC à 95%: 0,45–0,70; p<0,0001). Les analyses de sous-groupes confirment l’avantage en termes d’OS et de PFS du tiragolumab et de l’atézolizumab pour tous les sous-groupes étudiés.
Parmi les patient·es, 59,7% vs 45,5% ont répondu au médicament à l’étude, avec des rémissions complètes chez 11,5% vs 3,2%. La durée médiane de la réponse était de 7,1mois vs 4,3mois. L’immunothérapie supplémentaire a été bien tolérée dans l’ensemble, avec des effets secondaires de grade 3/4 chez 68,0% vs 61,2%, de grade 5 chez 5,7% vs 4,8% et des effets secondaires cliniquement significatifs chez 41,2% vs 39,2% des patient·es. Une partie du traitement a été arrêtée à cause d’effets secondaires par 19,7% vs 10,6% des patient·es.
Les auteur·es ont conclu que l’association tiragolumab, atézolizumab et chimiothérapie pourrait constituer un nouveau standard pour le traitement de première ligne du CEO localement avancé, non résécable ou métastatique.
Cancer du pancréas: réduction de la toxicité de la chimiothérapie
L’étude randomisée ALPACA (AIO-PAK-0114) a examiné si l’administration alternée de gemcitabine+nab-paclitaxel et de gemcitabine pouvait réduire la toxicité de la chimiothérapie chez les patient·es atteint·es d’adénocarcinome du pancréas.5 L’étude a porté sur 325patient·es provenant de 29centres et cabinets médicaux en Allemagne, qui n’avaient pas été traité·es jusqu’alors en situation métastatique.
Dans la phase d’induction, 319patient·es ont commencé le traitement pour trois cycles prévus de gemcitabine+nab-paclitaxel. Au total, 174patient·es ont obtenu une stabilisation de la maladie et ont été randomisé·es, 167 ont commencé soit le traitement alterné soit le traitement continu par gemcitabine+nab-paclitaxel. Le traitement alterné a permis d’obtenir une PFS numériquement plus longue, avec une médiane de 5,5mois vs 5,4mois (HR: 0,80; IC à 95%: 0,58–1,11; p=0,18) et une OS médiane comparable avec 10,5 vs 10,4mois (HR: 0,90; IC à 95%: 0,72–1,13; p=0,56) comparativement au traitement continu. La toxicité, notamment la neuropathie périphérique (14,1% vs 21,3%) et les infections (10,6% vs 20,0%), était en faveur du traitement en alternance.
Carcinome hépatocellulaire: TACE plus durvalumab plus bevacizumab
Selon les résultats de l’étude de phaseIII EMERALD-1, en double aveugle et contrôlée par placebo, le schéma bevacizumab+durvalumab associé à une chimio-embolisation transartérielle (TACE) pourrait constituer un nouveau standard de traitement pour les patient·es atteint·es d’un carcinome hépatocellulaire non résécable, mais admissibles à l’embolisation.6 Dans cette étude à trois bras, 616patient·es ont reçu soit durvalumab+TACE suivi de durvalumab+placebo (bras A), durvalumab+TACE suivi de durvalumab+bevacizumab (bras B) ou placebo+TACE suivi de placebo+placebo (bras C). Le critère d’évaluation principal de l’étude était la PFS comparée entre les bras B et C de l’étude. Le nombre de TACE consistait en 1 à 4procédures sur une période de 16semaines, à la discrétion des médecins traitants.
En médiane, le traitement systémique combiné a été initié 14semaines après la première dose de TACE. La majorité des patient·es ont subi une à deux procédures TACE.
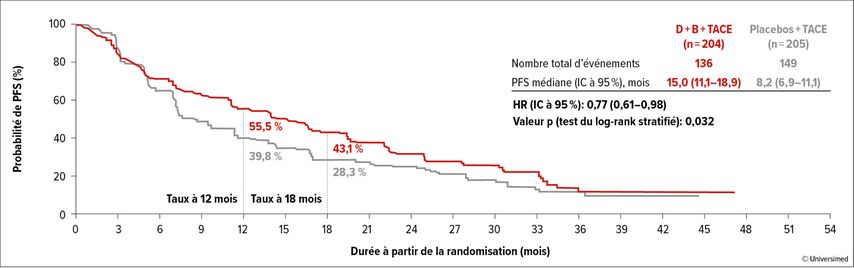
Au final, la PFS médiane a été prolongée de 6,8mois avec durvalumab+bevacizumab par rapport au bras avec double placebo (15,0 vs 8,2mois). Le risque de progression a été significativement réduit de 23% (HR: 0,77; IC à 95%: 0,61–0,98; p=0,032). Après 12mois, le taux de PFS était de 55,5% vs 39,8% et après 18mois, de 43,1% vs 28,3% (Fig. 2). En revanche, les courbes de Kaplan-Meier comparant les bras A et C n’étaient pas statistiquement différentes (HR: 0,94; IC à 95%: 0,75–1,19; p=0,638).
Fig. 2: Survie sans progression (PFS) sous durvalumab+bevacizumab+TACE (D+B+TACE) vs placebo+placebo vs TACE (modifié d’après Lencioni R etal.)6
Le délai médian avant à la progression (TTP) était de 22,9mois (bras A) vs 11,5mois (bras B) vs 10,0mois (bras C) avec un hazard ratio de 0,63 dans la comparaison des bras A et C (IC 95%: 0,48–0,82). Une réponse a été observée chez 43,6% vs 41,0% vs 29,6% des patient·es, avec une durée médiane de réponse de 22,1mois vs 14,0mois vs 16,4mois. Le profil d’effets secondaires correspondait aux données connues pour le durvalumab, le bevacizumab et la TACE.
Les auteur·es ont conclu que l’association durvalumab+bevacizumab et TACE pourrait constituer un nouveau standard pour le carcinome hépatocellulaire non résécable.
Source:
ASCO Gastrointestinal Cancers Symposium (ASCO GI), 18-20 janvier 2024, San Francisco, États-Unis.
Littérature:
1 Thierry A et al.: Nivolumab plus ipilimumab vs chemotherapy as first-line treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer: first results of the CheckMate 8HW study. ASCO GI 2024; Abstr. #LBA768 2 Shah MA et al.: First-line pembrolizumab plus chemotherapy for advanced esophageal cancer: 5-year outcomes from the phase 3 KEYNOTE-590 study. ASCO GI 2024; Abstr. #250 3 Chau I et al.: A quality-adjusted time without symptoms and toxicity (Q-TWIST) analysis comparing nivolumab plus ipilimumab or nivolumab plus chemotherapy vs. cemotherapy in patients with advanced esophageal squamous cell carcinoma: CheckMate 648. ASCO GI 2024; Abstr. #251 4 Hsu CH et al.: SKYSCRAPER-08: A phase III, randomized, double-blind, placebo-controlled study of first-line triagolumab + atezolizumab and chemotherapy in patients with esophageal squamous cell carcinoma (ESCC). ASCO GI 2024; Abstr. #245 5 Dorman K et al.: Alternating application of gemcitabine/nab-paclitaxel (Gem/nab-Pac) and Gem monotherapy or continuous application of Gem/nab-Pac after induction treatment for first-line treatment of metastatic pancreatic cancer: first results from the randomized phase 2 ALPACA study from the German AIO study group (AIO-PAK-0114). ASCO GI 2024; Abstr. #605 6 Lencioni R et al.: EMERALD-1: a phase 3, randomized, placebo-controlled study of transarterial chemoembolization combined with durvalumab with or without bevacizumab in participants with unresectable hepatocellular carcinoma eligible for embolization. ASCO GI 2024; Abstr. #LBA432
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...