Nouveaux traitements de référence, thérapies combinées et séquençage optimal
Compte-rendu:
Mag. pharm. Irene Senn, PhD
L’European Lung Cancer Congress (ELCC) s’est tenu à Prague du 20 au 23 mars. Cette année encore, l’accent a été principalement mis sur les immunothérapies et les thérapies ciblées. Ci-après, nous expliquons une sélection de résultats d’études actuelles qui ont le potentiel de marquer durablement le paysage thérapeutique à l’avenir.
NSCLC de stade précoce
Tislélizumab en périopératoire:
résultats chirurgicaux
Bien que la chirurgie soit le traitement de première ligne le plus efficace pour les patient·es atteint·es d’un cancer du poumon non à petites cellules (NSCLC) résécable de stade précoce, le taux de récidive tumorale à cinq ans reste inacceptablement élevé. Des stratégies néoadjuvantes et adjuvantes efficaces sont donc nécessaires de toute urgence. L’étude RATIONALE-315 a évalué l’efficacité et la sécurité du tislélizumab (TIS) en périopératoire en association avec une chimiothérapie (CT) néoadjuvante chez des patient·es atteint·es d’un NSCLC résécable destade II–IIIA. Elle a inclus 453 patient·es qui ont été randomisé·es pour recevoir soit TIS+CT, soit un placebo+CT, suivi d’une chirurgie et d’un traitement adjuvant (TIS ou placebo). Les résultats chirurgicaux ont été présentés à l’European Lung Cancer Congress 2024 (ELCC 2024).
Dans le bras sous TIS, le nombre de pneumectomies était nettement inférieur (8,4 par rapport à 12,1%). Le taux de résection R0 (95,3 par rapport à 93,1%) et le nombre médian de ganglions lymphatiques retirés (18 par rapport à 16) étaient similaires dans les deux groupes. Le délai médian entre la dernière dose néoadjuvante et la chirurgie était de 5,5 par rapport à 5,3 semaines, et il n’y avait pas non plus de différence significative entre les deux groupes en ce qui concerne les complications postopératoires (63,7 par rapport à 61,3%). Le TIS montre donc un potentiel d’amélioration de la réponse sans affecter négativement la faisabilité ou l’exhaustivité des interventions chirurgicales.1
NSCLC avancé et inopérable
L’étude PACIFIC-2 n’atteint pas les critères d’évaluation
Les données de l’étude PACIFIC-2 présentées lors de l’ELCC 2024 ont révélé que plus ne signifie pas toujours mieux. L’ajout de durvalumab (DUR) à la chimioradiothérapie (CRT) n’a apporté aucun bénéfice en termes de taux de réponse (ORR), de survie sans progression (PFS) ou de survie globale (OS) pour les patient·es atteint·es de NSCLC localement avancé et inopérable de stade III. L’étude de phase III a comparé l’efficacité de DUR+CRT suivi d’un traitement de consolidation par le DUR, par rapport à une CRT seule suivie d’un placebo. Aucune différence statistiquement significative n’a été observée entre les deux groupes en ce qui concerne l’ORR (60,7 par rapport à 60,6%), la PFS (13,8 par rapport à 9,4 mois; HR: 0,85) et l’OS (36,4 par rapport à 29,5 mois; HR: 1,03).2 Les résultats soulignent que le schéma thérapeutique PACIFIC initial, composé d’une CRT suivie d’un traitement de consolidation par le DUR, reste le traitement de référence pour ces patient·es.3,4
Nouvelles associations en cas de NSCLC EGFR-muté
Plusieurs présentations ont porté sur la manière dont le paysage thérapeutique pourrait évoluer à l’avenir dans le cas du NSCLC EGFRmut.
Thérapie combinée à l’osimertinib
L’étude FLAURA-2 évalue l’efficacité de l’association osimertinib plus chimiothérapie à base de platine (OSI+CT) par rapport à l’OSI seul chez les patient·es atteint·es de NSCLC EGFRmut avancé. Les données positives de cette étude en ce qui concerne la PFS ont déjà été présentées lors de la WorldConference on Lung Cancer (WCLC) 2023: la thérapie combinée a mis en évidence une augmentation significative de la PFS médiane de 38% (25,5 par rapport à 16,7 mois).5
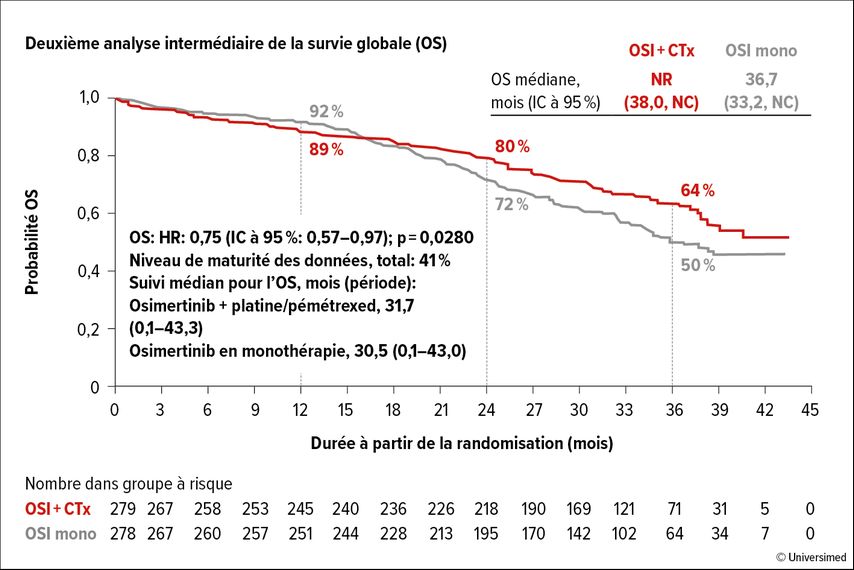
Les résultats présentés à l’ELCC 2024 confirment que l’association OSI+CT s’avère bénéfique même après la progression de la maladie. Un délai plus long avant le premier (30,7 par rapport à 25,4 mois) et le deuxième traitement ultérieur ainsi qu’une survie sans progression 2 (PFS2) plus longue ont été rapportés. De plus, une deuxième analyse intermédiaire des données relatives à l’OS après une durée de suivi d’environ 30 mois a été présentée. Elles révèlent une tendance en faveur de la thérapie combinée (HR: 0,75); le niveau de signification statistique défini n’a toutefois pas pu être atteint (Fig. 1).6
Fig. 1: Deuxième analyse intermédiaire des données sur l’OS de l’étude FLAURA-2 après une durée de suivi d’environ 30 mois (modifiée selon Valdiviezo Lama N. et al.)6
Thérapie combinée à l’amivantamab
L’étude MARIPOSA-2 compare l’association amivantamab plus chimiothérapie (AMI+CT) avec ou sans lazertinib (LAZ) à la CT seule chez des patient·es atteint·es de NSCLC EGFRmut métastatique ayant présenté une progression après la prise d’OSI. Auparavant, cette étude avait mis en évidence un avantage significatif en termes de PFS sous AMI+CT par rapport à la CT seule (HR: 0,48).7 L’analyse post-progression a maintenant été présentée à l’ELCC 2024. L’ajout d’AMI à la CT après la progression de la maladie a permis de prolonger significativement le délai avant l’arrêt du traitement (11,0 par rapport à 4,5 mois; HR: 0,37), le délai avant le traitement ultérieur (HR: 0,42) et la PFS2 (HR: 0,60) par rapport à la CT seule. En outre, près des deux tiers des patient·es de l’étude ont pu recevoir un traitement ultérieur, ce qui est important si l’on envisage un traitement de troisième ligne pour ce groupe. L’ajout d’AMI a été associé à un taux plus élevé de toxicité hématologique, mais principalement limité au premier cycle de traitement.8
Amivantamab: efficace malgré l’interruption du traitement
L’analyse exploratoire de l’étude MARIPOSA présentée à l’ELCC 2024 a montré que l’interruption précoce du traitement de première ligne par AMI+LAZ en raison d’événements indésirables n’avait aucun impact négatif sur les résultats thérapeutiques. La dose d’AMI a dû être interrompue pendant les quatre premiers mois de traitement chez environ la moitié des patient·es ayant reçu la thérapie combinée dans cette étude. Cependant, il est intéressant de noter que la PFS de ces patient·es était similaire à celle des patient·es n’ayant pas interrompu leur traitement (27,5 par rapport à 25,7 mois). Cette analyse suggère donc que les interruptions de traitement sont un moyen efficace de contrôler les effets secondaires sous AMI+LAZ sans compromettre la PFS.9
«EGFR exon-20 insertion-mutated NSCLC»
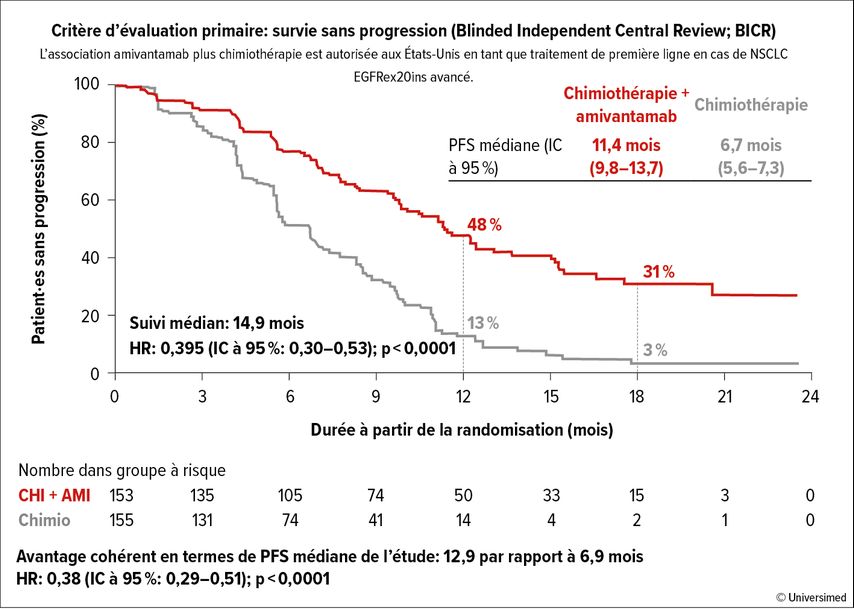
L’étude PAPILLON a évalué le bénéfice de l’association amivantamab (AMI) plus CT en cas de NSCLC avancé avec mutation de l’EGFR par insertion dans l’exon 20 (EGFRex20ins). L’ajout d’AMI à la CT de première ligne a entraîné une augmentation significative de la PFS (11,4 par rapport à 6,7 mois; HR: 0,395) par rapport à la CT seule (Fig. 2).
Fig. 2: L’ajout d’amivantamab à la chimiothérapie de première ligne dans l’étude PAPILLON a significativement prolongé la PFS par rapport à la chimiothérapie seule (modifié selon Felip E. et al.)10
En outre, le délai avant l’arrêt du traitement (13,2 par rapport à 7,5 mois; HR: 0,38) et le délai avant le prochain traitement systémique (17,7 par rapport à 9,9 mois; HR: 0,35) ont été prolongés.10 L’association AMI+CT constitue donc le nouveau traitement de première ligne pour les patient·es atteint·es de NSCLC EGFRex20ins de stade avancé ou métastatique et a été approuvée par la FDA le 1er mars 2024 pour cette indication (en association avec la CT et en monothérapie après progression).11
Données prometteuses sur les formulations sous-cutanées
Les avantages d’une injection sous-cutanée (SC) sont évidents: moins de réactions liées à la perfusion (IRR), moins de visites à l’hôpital et un plus grand confort de traitement pour les patient·es. Deux études portant sur les formulations sous-cutanées d’immunothérapies oncologiques ont été présentées à l’ELCC.
Amivantamab par voie sous-cutanée
Après l’administration intraveineuse d’amivantamab (AMI), 67% des personnes traitées présentent des IRR, ce qui signifie que la première dose doit être administrée sur deux jours.12 C’est pourquoi une formulation sous-cutanée d’AMI a été développée et est évaluée dans l’étude de phase Ib PALOMA. L’étude a déjà confirmé que la formulation SC permettait d’obtenir une exposition au médicament similaire à celle obtenue avec la formulation IV autorisée, tandis que les IRR sont significativement moins fréquentes (16%) et moins graves. Un avantage décisif de cette formulation est en outre le temps d’administration nettement raccourci s’élevant à seulement 7 à 10 minutes.
D’autres analyses de l’étude PALOMA ont maintenant montré que l’AMI peut être administré par voie sous-cutanée toutes les quatre semaines (q4w) sans que son efficacité ne soit compromise (au lieu de deux ou trois semaines pendant deux à quatre heures). L’incidence des IRR est restée inchangée (16%) et s’est limitée aux réactions de grade 1–2 après la première dose. Une dose de 3520mg (≥80kg: 4640mg) q4w a permis d’obtenir une exposition similaire à la dose IV autorisée.13
Atézolizumab par voie sous-cutanée
Les résultats de l’étude croisée IMscin002 présentés à l’ELCC 2024 confirment que l’administration SC est également préférée par les patient·es. Elle a atteint le critère d’évaluation primaire: 70,7% des patient·es ont déclaré préférer l’atézolizumab SC par rapport à 21,1% qui préféraient l’atézolizumab IV après trois cycles. Les principales raisons de cette préférence étaient le temps plus court passé à l’hôpital (64,4%), une sensation plus agréable (46,0%) et une charge émotionnelle moindre (29,9%). Après trois cycles, les patient·es ont choisi leur mode d’administration préféré pour la poursuite du traitement, et plus des trois quarts (79,4%) ont opté pour l’administration par voie sous-cutanée.14 L’année dernière, les résultats de l’étude IMscin001 ont montré que le traitement par atézolizumab administré par voie sous-cutanée et par voie intraveineuse chez les patient·es atteint·es de NSCLC présentait une exposition, une efficacité et une sécurité comparables.15 Cela a conduit à l’introduction, pour la première fois dans le monde, d’un traitement par un agent anti-PD-(L)1 administré par voie sous-cutanée par le NHS, en Angleterre.
Actualités sur le SCLC
Radiothérapie adjuvante en traitement de première ligne
Dans le cas du cancer du poumon à petites cellules de stade étendu (ES-SCLC), l’association durvalumab plus CT (DUR+étoposide/platine) s’est établie comme traitement de première ligne.16 L’étude de phase II LEAD examine actuellement le potentiel d’une radiothérapie de faible dose (LDRT, 15Gy/5f) adjuvante pour améliorer la réponse immunitaire. Les résultats présentés à l’ELCC 2024 indiquent qu’une LDRT adjuvante peut agir en synergie sans augmenter la toxicité. Le taux de réponse objective (ORR) était de 86,7%; les trois patient·es de l’étude présentant des métastases au niveau du SNC/cerveau ont obtenu une réponse partielle. La durée de réponse (DOR) médiane était de 7 mois. Après une durée de suivi médiane de 17,3 mois, la PFS médiane était de 8,3 mois; l’OS médiane n’a pas été atteinte. L’association DUR plus CT plus LDRT a été généralement bien tolérée.17 Ces résultats soutiennent une étude plus approfondie de cette association.
Tarlatamab: un activateur des cellules Tprometteur
En cas d’échec de la première chimio-immunothérapie, les options thérapeutiques sont limitées pour les patient·es atteint·es de SCLC. Le delta-like-ligand 3 (DLL3) est une cible thérapeutique potentielle, car il est exprimé de manière anormale à la surface des cellules du SCLC. Le tarlatamab, un activateur bispécifique des cellules T (BiTE®) est la première immunothérapie ciblant le DLL3 à faire l’objet d’études cliniques.18 Les résultats à long terme de l’étude dephase I DeLLphi-300, présentés à l’ELCC 2024, mettent en évidence un taux élevé de réponse durable, une survie médiane de 17,5 mois et une activité intracrânienne prometteuse dans une cohorte de 152 patient·es atteint·es d’ES-SCLC prétraité. De plus, les données de suivi n’ont pas trouvé de nouveaux signaux de sécurité.19
Source:
European Lung Cancer Congress, 20–23 mars 2024, Prague, République tchèque
Littérature:
1 Yue D et al.: Surgical outcomes from RATIONALE-315: randomized, double-blind, phase III study of perioperative tislelizumab with neoadjuvant chemotherapy in resectable NSCLC (Abstr. #1080). Ann Oncol 2024; 9(Suppl. 3): 1-10 2 Bardley J et al.: Durvalumab in combination with chemoradiotherapy for patients with unresectable stage III NSCLC: final results from PACIFIC-2. Ann Oncol 2024; 9(Suppl. 3): 1-53 3 Antonia SJ et al.: Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. NEJM 2017; 377(20): 1919-29 4 Remon J et al.: Early and locally advanced non-small-cell lung cancer: an update of the ESMO Clinical Practice Guidelines focusing on diagnosis, staging, systemic and local therapy. Ann Oncol 2021; 32(12): 1637-42 5 Planchard D et al.: Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. NEJM 2023; 389(21): 1935-48 6 Valdiviezo Lama N et al.: First-line (1L) osimertinib (osi) ± platinum-pemetrexed in EGFR-mutated (EGFRm) advanced NSCLC: FLAURA2 post-progression outcomes. Ann Oncol 2024; 9(Suppl. 3): 1-53 7 Passaro A et al.: Amivantamab plus chemotherapy (with or without lazertinib) vs chemotherapy in EGFR-mutated advanced NSCLC after progression on osimertinib: MARIPOSA-2, a phase III, global, randomized, controlled trial. Ann Oncol 2023; 34(Suppl. 2): S1254-S335 8 Gentzler R et al.: Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: a post-progression analysis of MARIPOSA-2. Ann Oncol 2024; 9(Suppl. 3): 1-53 9 Garcia Campelo MR et al.: Effect of amivantamab dose interruptions on efficacy and safety of first-line amivantamab plus lazertinib in EGFR-mutant advanced NSCLC: exploratory analyses from the MARIPOSA study. Ann Oncol 2024; 9(Suppl. 3): 1-53 10 Felip E et al.: Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR exon 20 insertion–mutated advanced NSCLC: analysis of post-progression endpoints from PAPILLON. Ann Oncol 2024; 9(Suppl. 3): 1-53 11 www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-amivantamab-vmjw-egfr-exon-20-insertion-mutated-non-small-cell-lung-cancer-indications (abgerufen am 1.4.2024) 12 Minchom AR et al.: Subcutaneous amivantamab (ami) in patients (pts) with advanced solid malignancies: the PALOMA study—updated safety and identification of the recommended phase 2 dose. JClin Oncol 2023; 41(Suppl. 16) 13 Leighl N et al.: Subcutaneous amivantamab administered every 4 weeks (Q4W) in patients with advanced solid malignancies: the phase 1b PALOMA study. Ann Oncol 2024; 9(Suppl. 3): 1-53 14 Cappuzzo F et al.: Primary results from IMscin002: a study to evaluate patient (pt)- and healthcare professional (HCP)-reported preferences for atezolizumab (atezo) subcutaneous (SC) vs intravenous (IV) for the treatment of NSCLC. Ann Oncol 2024; 9 (Suppl. 3): 1-53 15 Burotto M et al.: IMscin001 part 2: a randomised phase III, open-label, multicentre study examining the pharmacokinetics, efficacy, immunogenicity, and safety of atezolizumab subcutaneous versus intravenous administration in previously treated locally advanced or metastatic non-small-cell lung cancer and pharmacokinetics comparison with other approved indications. Ann Oncol 2023; 34(8): 693-702 16 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 17 Zhang Y et al.: Phase II study of low-dose radiation (LDRT) plus durvalumab (D) and etoposide/platinum/EP) as first-line treatment in ES-SCLC (LEAD): efficacy and safety results. Ann Oncol 2024; 9(Suppl. 3): 1-11 18 Giffin MJ et al.: AMG 757, a half-life extended, DLL3-targeted bispecific t-cell engager, shows high potency and sensitivity in preclinical models of small-cell lung cancer. Clin Cancer Res 2021; 27(5): 1526-37 19 Hummel HD et al.: Tarlatamab in previously treated small cell lung cancer (SCLC): DeLLphi-300 phase I study long-term outcomes and intracranial activity. Ann Oncol 2024; 9(Suppl. 3): 1-11
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...