Controverses sur la prise en charge des patient·es atteint·es de sarcome des tissus mous
Auteur·es:
Dre méd. Silvia Hofer
FMH Innere Medizin, FMH Onkologie
Zürich
E-mail: silvia.hofer@usz.ch
PD Dr méd. Christian Rothermundt
Leitender Arzt
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
E-mail: christian.rothermundt@kssg.ch
En raison de leur rareté et de leur hétérogénéité, les sarcomes des tissus mous («soft tissue sarcoma», STS) représentent un défi pour toutes les personnes concernées lors de la pose du diagnostic, dans les décisions relatives à un concept thérapeutique multimodal ainsi que le type et la fréquence du suivi. En Europe, l’incidence des sarcomes des tissus mous est de 4–9/100000/an.1 Ils apparaissent au niveau des extrémités (ESTS), de l’abdomen/du rétropéritoine (RPS) et du torse, mais on les retrouve également presque partout ailleurs dans le corps.
Depuis la réédition de la classification de l’OMS en 2020 et au cours des années suivantes, près de 150 sous-types de sarcomes des tissus mous ont été caractérisés, lesquels se distinguent par leur morphologie, leur immunohistochimie, leurs propriétés moléculaires et leur comportement biologique.2
Ces dernières années, des efforts ont été déployés dans le monde entier pour améliorer la prise en charge des sarcomes des tissus mous (STS) sur la base de diagnostics pathologiques/moléculaires et radiologiques perfectionnés. De nombreux types histologiques sont extrêmement rares (de l’ordre de 0,1 cas/100000/an), de sorte que même les pathologistes et clinicien·nes spécialisé·es ne les rencontrent pas plus d’une fois au cours de leur carrière. Les centres multidisciplinaires spécialisés dans le sarcome traitant un nombre élevé de cas sont donc une condition préalable à une prise en charge optimale des patient·es, même s’il n’est pas nécessaire que tous les centres proposent l’ensemble de l’offre hautement spécialisée. Un réseau établi bien au-delà des frontières nationales est essentiel pour une prise en charge optimale.
Directives sur les sarcomes des tissus mous
Comme pour la plupart des cancers, il existe des directives interdisciplinaires pour le diagnostic et le traitement des sarcomes des tissus mous, comme les directives anglaises de l’ESMO (2021), la directive allemande S3 (2021) et la directive en langue allemande d’Onkopedia (2019).3–5 Malgré les nombreuses déclarations et recommandations claires contenues dans ces directives, de nombreuses questions restent ouvertes ou font l’objet de controverses dans la pratique clinique quotidienne. Les preuves issues d’études cliniques font souvent défaut en raison du faible nombre de cas, et de nouveaux sous-types moléculaires de STS s’ajoutent en permanence. Traiter tous les sarcomes biologiquement différents de la même manière est toutefois problématique et n’a pas eu beaucoup de succès par le passé.
Conférence de consensus sur la prise en charge clinique des STS
Les conférences de consensus en oncologie sur les avis controversés en matière de diagnostic, de traitement et de suivi des cancers, au cours desquelles des expert·es de renommée internationale débattent et votent à intervalles réguliers, ont déjà une longue tradition en Suisse. La «St. Gallen International Breast Cancer Conference» (SGBCC), dont la 18e édition s’est tenue en 2023, et l’«Advanced Prostate Cancer Consensus Conference» (APCCC), qui a lieu tous les deux ans depuis 2015, sont connues dans le monde entier. Les deux conférences attirent l’attention grâce à leur caractère international et à l’échange des expert·es qui permet de dégager un consensus.
Une conférence de consensus nous a semblé d’autant plus nécessaire pour les sarcomes des tissus mous que l’obtention de preuves robustes à partir d’études contrôlées prospectives s’est toujours heurtée à la rareté des différents sous-types de STS. La pratique clinique quotidienne requiert pourtant des procédures acceptées, des recommandations thérapeutiques contraignantes, même si elles ne sont éventuellement que de nature temporaire, et bien entendu des indicateurs de qualité reconnus. Les résultats d’une telle conférence de consensus servent de base aux parcours de soins actuellement acceptés, aux négociations avec les caisses-maladie, d’arguments dans la politique et à la planification d’études cliniques ou de registres en collaboration internationale.
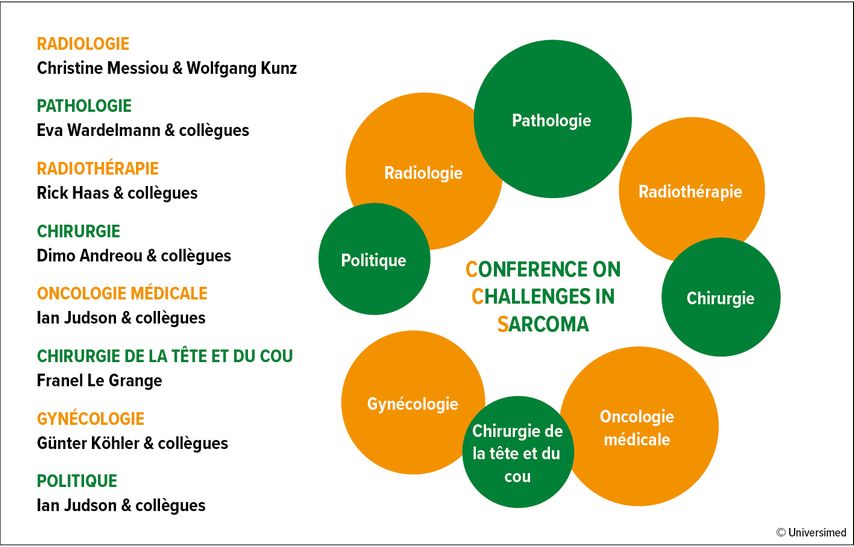
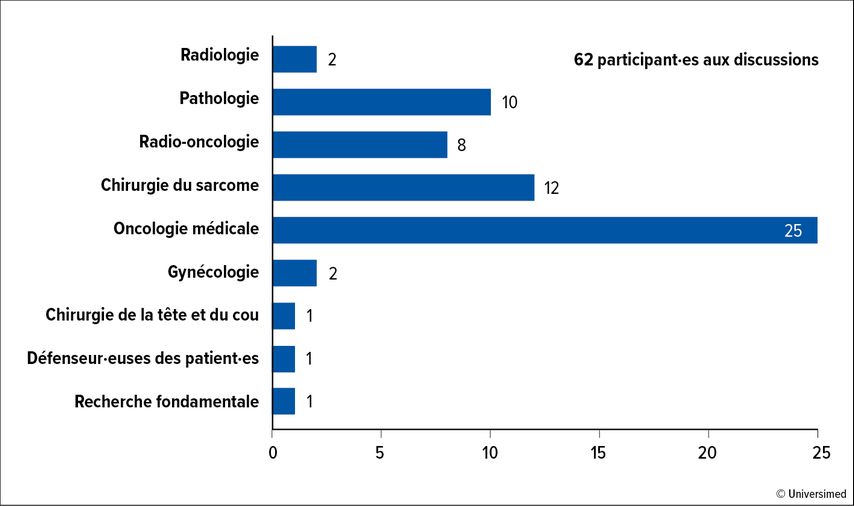
Cette nécessité a donné naissance en 2021 à huit groupes de travail interdisciplinaires (Fig.1 ) composés de 62 expert·es européen·nes et suisses du sarcome (Fig. 2), qui ont discuté de déclarations controversées sur les STS et formulé 220 questions à partir de celles-ci. Ces dernières ont été abordées avant et lors de la première conférence de consensus sur le sarcome qui s’est tenue à Saint-Gall en mai 2022.
Fig. 1: Groupes de travail interdisciplinaires à la conférence de consensus sur les sarcomes des tissus mous
Résultats de la première conférence de consensus sur le sarcome
En amont de la conférence, des déclarations controversées ont été échangées, puis définies de manière analogue à la méthode Delphi. Ces 220 déclarations ont ensuite fait l’objet d’un vote en ligne par les expert·es du sarcome. Les 20 et 21 mai 2022, les résultats ont été discutés à Saint-Gall et le vote a été répété sur 62 questions. Certaines questions n’autorisaient qu’une seule réponse, d’autres plusieurs réponses. Pour chaque question, il était également possible de s’abstenir si l’on ne se sentait pas compétent·e dans ce domaine ou si on avait l’impression que la question n’était pas clairement posée. En cas de taux d’abstention de 33% ou plus, la question a été supprimée de l’évaluation. Un consensus et un consensus clair ont été définis par un accord ≥75% et ≥95%, respectivement.
Consensus sur le diagnostic des STS
La pathologie et la radiologie du sarcome sont les deux piliers du diagnostic des STS. Elles se complètent, ce qui suppose une bonne communication entre les deux disciplines. Les critères de classification des STS doivent impérativement être déterminés à partir des prélèvements de biopsie (guidés par une imagerie préalablement demandée), car les traitements préopératoires des STS à haut risque présentent à plusieurs égards des avantages pour une approche thérapeutique curative. Une standardisation des comptes-rendus de pathologie intégrant des informations sur les résultats radiologiques a été demandée. Les mêmes exigences ont été imposées à l’évaluation de la réponse postopératoire. Un consensus clair (accord égal à 100%) s’est dégagé sur le fait que les tumeurs mésenchymateuses présentant des anomalies morphologiques, du comportement biologique ou des anomalies moléculaires devaient impérativement être évaluées par un·e pathologiste du sarcome de référence. Les critères suivants, auxquels les pathologistes de référence doivent satisfaire, ont été approuvés à la majorité:
-
mise en place de contrôles de qualité du diagnostic à l’institut,
-
participation régulière à des «Tumor Boards» interdisciplinaires sur le sarcome,
-
collaboration avec des laboratoires validés pour le diagnostic moléculaire,
-
échanges réguliers avec des pathologistes de référence,
-
connaissance des méthodes diagnostiques les plus récentes (anticorps, tests moléculaires),
-
réalisation régulière de NGS,
-
formation d’au moins un an dans un institut avec un·e pathologiste de référence,
-
fonctions de chercheur·se et de formateur·rice en pathologie du sarcome,
-
plus de 100 diagnostics primaires de STS par an.
Consensus sur la prise en charge périopératoire des STS
La prise en charge périopératoire du STS a fait l’objet de nombreuses discussions. Bien qu’il existe des données sur le traitement systémique périopératoire des STS à haut risque, il manque à ce jour une étude avec un bras d’observation sans traitement systémique correspondant. La définition exacte du «STS à haut risque» n’est pas claire. La taille, la profondeur et le grade sont utilisés comme indicateurs de risque; l’outil SARCULATOR peut également servir à calculer le risque, mais il ne prend en compte qu’une partie des sous-types de STS, ou encore les signatures moléculaires.
De plus, il n’existe aucune donnée robuste sur la durée du traitement systémique périopératoire, sur le moment opportun pour initier le traitement (pré- ou postopératoire) et sur les médicaments les plus appropriés.
Les nombreux sous-types de STS rendent le choix des substances difficile. Lors de la conférence de consensus, la «disease-free survival» (DFS) et l’«overall survival» (OS) ont été jugées à peu près équivalentes comme critère d’évaluation primaire optimal pour une future étude sur le traitement systémique périopératoire.
Des questions ont également été posées sur la radiothérapie (RT) périopératoire. Des protocoles courts sont de plus en plus utilisés pour les sarcomes, comme pour certaines autres tumeurs. Leur équivalence est actuellement validée dans des études, avec des modifications correspondantes de la dose de rayons.
Même si une RT préopératoire est privilégiée, des arguments ont pu être formulés en faveur d’une RT postopératoire, à savoir la crainte de troubles de la cicatrisation et une divergence entre l’évaluation du grade sur biopsie («sampling error») et le résultat de l’imagerie initiale.
Consensus sur la procédure chirurgicale
La planification d’une résection curative se fait après l’imagerie initiale et l’analyse histologique de la biopsie préthérapeutique obligatoire par le «Tumor Board» interdisciplinaire sur le sarcome. Les chirurgien·nes évaluent alors la probabilité d’une résection R0 et discutent des traitements préalables qui la soutiennent. Souvent, seule une résection R1 est possible pour des raisons anatomiques en cas de sarcomes localisés dans l’espace rétropéritonéal; elle est donc acceptée comme procédure. Dans des cas exceptionnels, les sarcomes localisés au niveau des extrémités peuvent faire l’objet d’une résection marginale planifiée, si cela permet d’éviter une perte fonctionnelle importante.
L’indication d’une nouvelle résection en cas de marges de résection positives, avec ou sans reliquat tumoral macroscopique, a donné lieu à de nombreuses discussions. Cette situation est surtout rencontrée après des résections non planifiées («résections whoops»), qui doivent être évitées par une anticipation et une attention accrue, surtout des chirurgien·nes généralistes ne faisant pas partie des réseaux du sarcome.
Un consensus clair a été atteint sur le fait que les principes de la chirurgie des sarcomes doivent également s’appliquer aux disciplines de la chirurgie de la tête et du cou, de la dermatologie ainsi que de la chirurgie gynécologique.
Consensus sur l’oligométastase
Pour pouvoir discuter des options thérapeutiques (curatives par rapport à palliatives) en cas d’oligométastase, il fallait d’abord se mettre d’accord sur la définition de l’«oligométastase dans les STS».
Les critères qui ont été favorisés sont les suivants: le nombre de lésions (près de la moitié des panélistes ont voté pour), suivi du nombre d’organes atteints, du délai jusqu’au diagnostic primaire, de la dynamique de développement des lésions et, enfin, des antécédents de métastases de STS chez le·a patient·e. Un consensus a pu être atteint sur le fait qu’il convient d’abord de réaliser une imagerie évolutive avant de proposer un traitement local en présence de métastases pulmonaires apparues de manière synchrone au moment du diagnostic de STS. L’algorithme de l’European Society for Radiotherapy and Oncology et de l’European Organisation for Research and Treatment of Cancer a été jugé utile dans le contexte de l’oligométastase.6
Consensus sur les STS avancés
La pathologie moléculaire devient de plus en plus pertinente pour les décisions thérapeutiques dans les STS avancés. Si, jusqu’à récemment, une monothérapie par l’anthracycline (éventuellement combinée à l’ifosfamide en cas de «pression thérapeutique») était acceptée en première ligne dans une approche palliative, on exige de plus en plus des approches thérapeutiques ciblées en première ligne et dans les lignes de traitement suivantes, conformément au profil moléculaire. La disponibilité de tels médicaments, qui ne sont pas autorisés à cet effet, constitue un obstacle majeur. Les expert·es du sarcome et la politique sont ici sollicités, une harmonisation nationale et internationale de l’approche est indispensable.
En raison de l’absence d’études randomisées due au faible nombre de cas, les données des registres, les données sur la qualité de vie et le «patient-reported outcome» (PRO) sont nécessaires pour argumenter avec les autorités réglementaires. Comme l’a indiqué notre conférence de consensus, des étapes et ces mesures sont uniquement possibles grâce à une collaboration internationale et en utilisant des protocoles thérapeutiques développés par des consortiums académiques, par exemple l’EORTC.
Conclusion et perspectives
Sans surprise, seules quelques questions ont fait l’objet d’un consensus (13,7%), voire d’un consensus clair (7,3%). Le bénéfice positif que nous tirons des votes pour la pratique clinique quotidienne est par exemple une base de négociation avec les caisses-maladie pour une recommandation de traitement «hors étiquette». Certains avis controversés restants peuvent être examinés et clarifiés dans des études prospectives en collaboration internationale. Tous·tes les participant·es à la conférence étaient conscient·es que des questions sur les sarcomes des tissus mous allaient subsister, qui ne pourront jamais être examinées dans le cadre d’études en raison de la rareté des STS.
Un consensus intéressant a été atteint dans la recherche de critères déontologiques pour les expert·es du sarcome dans les différentes disciplines (critères de qualité). Tous les résultats de la conférence de consensus ont été publiés dans l’European Journal of Cancer 2022.7
À la demande générale des panélistes, une deuxième conférence de consensus est en préparation et se tient les 3 et 4 mai 2024 à Saint-Gall. L’inscription est ouverte aux personnes intéressées à l’adresse suivante: https://www.kssg.ch/events/2024/conference-on-challenges-sarcoma-2024
Littérature:
1 de Pinieux G et al.: Nationwide incidence of sarcomas and connective tissue tumors of intermediate malignancy over four years using an expert pathology review network. PLoS One 2021; 16: e0246958 2 Soft Tissue and Bone Tumours. WHO Classification of Tumours, 5th Ed. Vol. 3, 2020 3 Gronchi A et al.: Soft tissue and visceral sarcomas: ESMOEURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021; 32: 1348e65 4 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Adulte Weichgewebesarkome, Langversion 1.1, 2022, AWMF-Registernummer: 032/044OL 5 Onkopedia Leitlinien: Weichgewebssarkome (maligne Weichgewebstumoren) des Erwachsenen. 2019 ( www.onkopedia.com ) 6 Guckenberger M et al.: Characterisation and classification of oligometastatic disease: a European Society for Radiotherapy and Oncology and European Organisation for Research and Treatment of Cancer consensus recommendation. Lancet Oncol 2020; 21(1): e18-28 7 Rothermundt C et al.: Writing committee on behalf of CSSS panellists. Controversies in the management of patients with soft tissue sarcoma: recommendations of the Conference on State of Science in Sarcoma 2022. Eur J Cancer 2023; 180: 158-79
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...