LMC en phase chronique: asciminib? – Le CPX-351 dans la LMA: nouvelle évaluation
Compte-rendu:
Dre Ine Schmale
Les patient·es qui viennent de recevoir un diagnostic de leucémie myéloïde chronique (LMC) ont besoin de traitements qui offrent une efficacité à long terme associée à une bonne tolérabilité. L’asciminib a montré une supériorité par rapport aux autres ITK dans l’étude ASC4FIRST. Lors du congrès de l’ASH de cette année, des critères d’évaluation secondaires importants ont été présentés. L’étude de phaseIII CPX-351-301 sur le traitement par CPX-351 versus schéma 7+3 dans la leucémie myéloïde aiguë (LMA) a été réévaluée en tenant compte de la nouvelle classification de l’OMS – ce qui a fourni des résultats importants.
Leucémie myéloïde chronique
Stratégie efficace avec l’imatinib après l’induction par ponatinib
Le ponatinib est l’ITK compétitif de l’ATP le plus puissant contre le transcrit de fusion BCR-ABL1. Le ponatinib est autorisé comme traitement de rattrapage chez les patient·es atteint·es de leucémie myéloïde chronique (LMC) en phase chronique après les inhibiteurs de tyrosine kinase (ITK) de première et deuxième génération. L’étude EPIC sur l’utilisation du ponatinib en traitement de première ligne a été terminée prématurément, avec 307 patient·es sur les 528 prévus pour la LMC. Les patient·es ayant déjà reçu du ponatinib sont passé·es à d’autres ITK de première ligne, avec de bons résultats thérapeutiques. Ces observations ont donné lieu à l’étude académique française TIPI, dans laquelle 170 patient·es atteint·es de LMC récemment diagnostiquée ont reçu pendant 6 mois un traitement d’induction par ponatinib (30mg) suivi d’une consolidation par imatinib (400mg).1 Le critère d’évaluation primaire était une réponse moléculaire profonde (RM4,5) après 36 mois. Si, à partir de ce moment, une RM4,5 était présente depuis ≥2 ans, l’imatinib pouvait être arrêté.
Après un suivi médian de 18 mois, 89% des patient·es avaient terminé l’induction par ponatinib. Deux patient·es sont décédé·es des suites d’une mort cardiaque subite ou d’une crise blastique myéloïde pendant la phase de ponatinib, un patient est décédé des suites d’une crise blastique lymphatique sous imatinib. À la fin de la phase de ponatinib, 92% des patient·es n’avaient présenté aucun événement, vs 86% à 12 mois sous imatinib. L’incidence cumulée des rémissions moléculaires montre une augmentation des rémissions moléculaires majeures (RMM) chez 9,5% des patient·es à 3 mois à 44% à 6 mois. Les RMM ont augmenté de manière continue jusqu’à 70% à 18 mois. Le taux de rémissions RM4 est passé de 1,2% à 3 mois à 23% à 6 mois, pour atteindre 40% à 18 mois. Une réponse RM4,5 a été rapportée chez 13,25% des patient·es à 18 mois. Des effets indésirables liés au traitement de grade≥3 ont été observés chez 109 patient·es (81%) sous ponatinib et 25 patient·es (68%) sous imatinib. Sous ponatinib, des effets secondaires cardiaques de grade≥3 sont survenus chez 6 patient·es (4,5%) et des effets secondaires vasculaires de grade≥3, chez 17 patient·es (10%). Des effets secondaires cardiovasculaires (hypertension de grade3 dans tous les cas) ont été rapportés chez 3 autres patient·es sous imatinib.
Conclusion: La majorité des rémissions moléculaires obtenues avec le ponatinib ont été maintenues avec le traitement subséquent par imatinib. Les effets secondaires ont pu être réduits de manière significative avec la consolidation par imatinib.
Supériorité de l’asciminib par rapport aux ITK de première ligne
L’analyse primaire de l’étude de phaseIII ASC4FIRST chez des patient·es ayant reçu récemment un diagnostic de LMC a montré des taux plus élevés de réponse moléculaire majeure (RMM) à 48 semaines sous asciminib par rapport à d’autres ITK de première ligne choisis par le praticien, à la fois pour tous les ITK (67,7% vs 49,0%; p<0,001) et pour les ITK de la strate de l’imatinib (69,3% vs 40,2%; p<0,001). Avec un suivi médian de 2 ans, ces résultats ont également été confirmés après 96 semaines.2
Une RMM après 96 semaines était significativement plus fréquente avec le traitement par asciminib, avec une différence de 22,4% en valeur absolue (74,1% vs 52,0%) (p<0,001). Cela a été confirmé à la fois pour les patient·es sous ITK de la strate de l’imatinib (76,2% vs 47,1%) et pour ceux·celles recevant un ITK de deuxième génération (72,9% vs 56,9%). L’incidence de RMM cumulée était de 66,5% dans le groupe asciminib vs 46,3% dans le groupe de contrôle à 48 semaines, et de 80,5% vs 62,1% à 96 semaines. Les rémissions moléculaires profondes à 96 semaines étaient globalement plus fréquentes sous asciminib, et ce, dans les deux strates. Cumulativement, les rémissions moléculaires ont continué à s’approfondir avec la poursuite du traitement, des rémissions profondes étant systématiquement plus fréquentes sous asciminib par rapport aux autres ITK. Des analyses de sous-groupes ont montré l’avantage du traitement par asciminib pour tous les groupes de patient·es concernés.
En ce qui concerne l’innocuité et la tolérabilité des traitements, un nombre inférieur de patient·es ont présenté des effets secondaires de grade≥3 sous asciminib. La proportion de patient·es ayant arrêté le traitement en raison d’effets secondaires (6,0% vs 12,7%) ou d’un résultat thérapeutique insatisfaisant (9,5% vs 20,6%) était deux fois plus élevée avec les ITK choisis par le praticien qu’avec l’asciminib.
Conclusion: L’asciminib présente un profil bénéfice/risque plus avantageux que les autres ITK. L’asciminib devrait être la nouvelle norme thérapeutique pour les patient·es atteint·es de LMC en phase chronique nouvellement diagnostiquée.
Leucémie myéloïde aiguë
Avantage significatif du CPX-351 vs schéma 7+3 uniquement pour la LMA liée à des anomalies myélodysplasiques
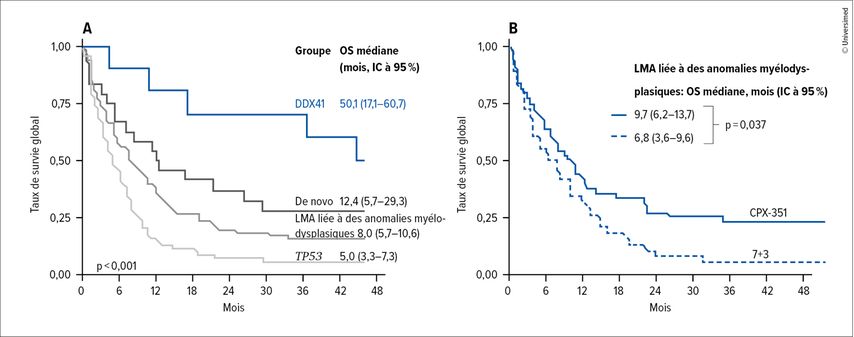
Dans les versions révisées du modèle diagnostique de l’OMS et du modèle pronostique ELN-2022, les sous-classes biologiques de leucémie myéloïde aiguë (LMA) sont définies par des mutations génétiques. Le CPX-351, une association de daunorubicine liposomale et de cytarabine, a été approuvé pour le traitement de la LMA secondaire sur la base des résultats de l’étude de phaseIII CPX-351-301, qui a montré une augmentation de la survie globale (OS) par rapport au schéma 7+3. Dans le cadre d’une nouvelle évaluation des données de l’étude, on a utilisé la nouvelle classification de l’OMS, avec LMA de novo (mutation de NMP1), LMA liée à des anomalies myélodysplasiques (mutations des gènes SRSF2, SF3B1, EZH2, U2AF1, ZRSR2, BCOR, STAG2, ASXL1), mutation de TP53 et mutations germinales de DDX41.3
Alors que l’OS ne différait pas selon les groupements en fonction des critères d’inclusion cliniques (LMA liée à des anomalies myélodysplasiques avec antécédents de SMD/LMMC; LMA liée à des anomalies myélodysplasiques selon la cytogénétique; LMA-t), un meilleur pronostic a pu être démontré pour l’ensemble de la population de l’étude avec les nouveaux sous-groupes génétiques pour le groupe DDX41 (OS médiane: 50,1 mois) (Fig. 1A). L’OS médiane était de 12,4 mois dans les cas de LMA de novo, de 8,0 mois dans les cas de LMA liée à des anomalies myélodysplasiques et de 5,0 mois dans les cas de mutation de TP53. En comparant les deux traitements, aucune différence statistiquement significative n’a été observée pour le groupe TP53 (OS médiane: 4,5 vs 5,1 mois; p=0,70), le groupe LMA de novo (OS médiane: 11,3 vs 16,9 mois; p=0,77) ou le groupe DDX41 (OS médiane: 56,4 vs 17,1 mois; p=0,11). La différence d’OS entre les deux groupe de l’étude n’a atteint la limite de signification statistique que pour le groupe LMA liée à des anomalies myélodysplasiques (OS médiane: 9,7 vs 6,8 mois; p=0,037; Fig.1B), mais uniquement en association avec une chimiothérapie de consolidation à haute dose. Dans tous les sous-groupes moléculaires, un retard de récupération du taux de plaquettes a été observé sous CPX-351. Dans tous les sous-groupes génétiques, à l’exception du groupe DDX41, la mortalité précoce était élevée dans les deux groupe de l’étude.
Fig.1: Une nouvelle évaluation de l’étude de phaseIII CPX-351-301 tenant compte de la nouvelle classification de l’OMS montre un mauvais pronostic global pour la LMA TP53 (A) et un avantage significatif en termes d’OS pour le traitement par CPX-351 par rapport au schéma 7+3 uniquement chez les patient·es présentant une LMA liée à des anomalies myélodysplasiques (B; modifiée selon Shimony S et al.)3
Conclusion: Le traitement par CPX-351 a prolongé l’OS chez les patient·es atteint·es de LMA liée à des anomalies myélodysplasiques, mais n’a pas montré d’avantage par rapport au schéma 7+3 pour la LMA avec mutation de TP53 et la LMA de novo. Seulement 5% des patient·es inclus·es dans l’étude de phaseIII présentaient une mutation germinale de DDX41. Aucune différence significative n’a pu être mise en évidence pour ce groupe.
Vénétoclax et azacitidine après une récidive moléculaire
Le suivi moléculaire de la maladie résiduelle minimale (MRM) mesurable par PCR est bien établi pour les patient·es atteint·es de LMA avec mutations de NPM1, transcrits de fusion RUNX1-RUNX1T1 ou CBFB-MYH11. Si l’on traite dès la récidive moléculaire de la maladie, le pronostic de la LMA avec mutation de NPM1 ou CBF («core binding factor») est meilleur que si l’on attend la récidive morphologique de la maladie. Une étude rétrospective en situation réelle a examiné si le traitement préemptif par vénétoclax et azacitidine pouvait apporter un bénéfice après un traitement d’induction de première ligne.4 Le critère d’évaluation primaire était le taux de réponse moléculaire secondaire, les critères d’évaluation secondaires étaient le taux de transplantation de cellules souches, la sécurité et le taux de récidive morphologique.
Les données de 70 patient·es d’un âge médian de 57 ans ont été analysées. Une mutation de NPM1 était présente dans 94,3% des cas et une LMA CBF, dans 5,7% des cas. Parmi les patient·es, 30% présentaient des mutations de FLT3-ITD et 17%, des mutations de FLT3-TKD. Le risque cytogénétique était intermédiaire chez la plupart des patient·es (94,3%) et le risque de progression selon les critères ELN-2022 était faible chez 69% des patient·es. Sur l’ensemble des patient·es, 63% ont présenté une rémission moléculaire complète pendant le traitement de première ligne, 37% un faible niveau de MRM.
Le délai médian entre le diagnostic et la récidive moléculaire était de 10 mois, et de 48 jours entre la récidive moléculaire et le traitement par vénétoclax plus azacitidine. Les patient·es ont reçu en moyenne 2 cycles de traitement avant une allogreffe de cellules souches (n=54, 77%) et 9 cycles si l’allogreffe n’a pas pu être réalisée (n=16, 23%). Au final, 78% des participant·es ont répondu au traitement par vénétoclax plus azacitidine avec une rémission moléculaire. Une rémission morphologique complète a été observée chez 83% de ces personnes. L’OS médiane n’avait pas encore été atteinte avec une durée médiane de suivi de 22,5 mois. Après 1 an, 95% des patient·es étaient encore en vie et 83% après 2 ans. On a observé une récidive morphologique chez 14 patient·es, 2 avant et 3 après la transplantation et 9 chez des patient·es n’ayant pas reçu de transplantation.
Sur les 54 patient·es ayant reçu une allogreffe de cellules souches, seul·es 3 ont subi une récidive morphologique et 87% étaient en rémission moléculaire au moment de l’évaluation. Sur les 16 patient·es n’ayant pas reçu d’allogreffe de cellules souches, 7 n’ont pas présenté de récidive morphologique et 50% des patient·es présentaient une rémission moléculaire. Après 1 an, 93% des participant·es vivaient sans transplantation, et 71% après 2 ans.
Le traitement par vénétoclax plus azacitidine après une récidive moléculaire était sûr et également possible sans prophylaxie par posaconazole dans le cadre d’un traitement ambulatoire. Une neutropénie fébrile (grade3–4) a été rapportée chez 16% des patient·es.
Conclusion: Le vénétoclax plus l’azacitidine ont induit des taux élevés de rémission moléculaire complète dans le cadre d’une étude rétrospective chez des patient·es atteint·es de LMA avec mutation de NPM1 et en récidive moléculaire. Cette combinaison efficace pourrait constituer une stratégie appropriée pour la transition en attente d’une transplantation.
Leucémie lymphoblastique aiguë: blinatumomab plus chimiothérapie chez des enfants sélectionnés
Les patient·es pédiatriques atteint·es d’une leucémie lymphoblastique aiguë (LLA) nouvellement diagnostiquée et présentant un risque standard selon les critères du NCI ont été réparti·es en trois groupes de risque après le traitement d’induction dans l’étude de phaseIII AALL1731:5un groupe de patient·es à risque standard avec un bon pronostic (cytogénétique favorable et RMR sérique <1% au jour 8 et MRM médullaire <0,01% à la fin du traitement d’induction), un groupe de patient·es à risque standard avec un mauvais pronostic (cytogénétique défavorable ou cytogénétique neutre ou MRM ≥0,01% à la fin du traitement d’induction) et un groupe de patient·es à risque standard qui n’appartenaient à aucun des deux autres groupes. Les patient·es du groupe avec un bon pronostic et ceux·celles avec un pronostic ni bon ni mauvais et une MRM non détectable par séquençage à haut débit (SHD) des immunoglobulines ont reçu une chimiothérapie standard. Les patient·es à haut risque et présentant une MRM ≥0,1% à la fin du traitement ont reçu une chimiothérapie plus blinatumomab. Les patient·es avec un pronostic ni bon ni mauvais et une MRM détectable par SHD (groupes A et B), ainsi que les patient·es avec un mauvais pronostic et une MRM <0,1% à la fin du traitement d’induction (groupes C et D) ont été randomisé·es pour recevoir une chimiothérapie sans ou avec 2 cycles de blinatumomab. Au total, 1440 patient·es ont été inclus·es dans les 4 groupes de l’étude.
L’administration supplémentaire de blinatumomab a permis de prolonger significativement la survie sans maladie (DFS) pour l’ensemble de la population randomisée de l’étude (HR: 0,39) et dans la comparaison entre les groupes de l’étude A et B (HR: 0,33) et C et D (HR: 0,45). Après trois ans, 87,9% vs 96%, 90,2% vs 97,5% et 84,8% vs 94,1% des patient·es étaient exempt·es de la maladie. Le bénéfice de l’administration de blinatumomab a été observé dans tous les sous-groupes étudiés. Dans l’ensemble, le traitement a été bien toléré. En comparant les groupes A et B de l’étude, les neutropénies fébriles de grade3+ (39,6% vs 47,0%; p=0,05) et les infections associées aux cathéters de grade3+ (5,1% vs 14,8%; p<0,001) étaient plus fréquentes avec le traitement à base de blinatumomab.
Conclusion: L’ajout de blinatumomab à une chimiothérapie de consolidation est la nouvelle norme thérapeutique en cas de LLA nouvellement diagnostiquée chez des patient·es pédiatriques sélectionné·es présentant un risque standard.
Source:
Congrès annuel de l’Amercian Society of Hematology (ASH), du 7 au 10 décembre 2024, San Diego, USA
Littérature:
1 Nicolini FE et al.: 18-month follow-up of the trial of imatinib after ponatinib induction in the front-line treatment of chronic phase chronic myeloid leukemia setting. ASH 2024; Abstr. #478 2 Cortes JE et al.: Asciminib demonstrates favorable safety and tolerability compared with each investigator-selected tyrosine kinase inhibitor in newly diagnosed chronic myeloid leukemia in chronic phase in the pivotal phase 3 ASC4FIRST study: week 96 update. ASH 2024; Abstr. #475 3 Shimony S et al.: AML-MR mutations drive the benefit of CPX-351 over 7+3 in the pivotal phase 3 AML trial. ASH 2024; Abstr. #60 4 Higué J et al.: Real-world multicenter evaluation of venetoclax and azacitidine for molecular relapse after first line intensive chemotherapy in patients with NPM1 mutated or core binding factor (CBF) AML. A FILO study. ASH 2024; Abstr. #58 5 Rau RE et al.: Blinatumomab added to chemotherapy improves disease-free survival in newly diagnosed NCI standard risk pediatric B-acute lymphoblastic leukemia: results from the randomized children’s oncology group. ASH 2024; Abstr. #1
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...