Nouvelles normes: IPC, CAM et EV
Compte-rendu:
Dre méd. Judith Moser
Auteure:
PD Dre méd. Maria De Santis
Sektion interdisziplinäre Urologische Onkologie, Charité Universitätsmedizin Berlin
E-mail: maria.de-santis@charite.de
Le traitement de première ligne du carcinome urothélial localement avancé ou métastatique a été révolutionné par les études de phaseIII EV-302/KEYNOTE-A39 et CheckMate 901. Cependant, le traitement par le conjugué anticorps/principe actif enfortumab védotine, comme celui par inhibiteur de point de contrôle, nécessite une gestion minutieuse des effets secondaires.
Alors que pendant des décennies, le traitement systémique du carcinome urothélial métastatique (CUm) ne comportait que des chimiothérapies, un nombre croissant de nouvelles options comme les inhibiteurs de points de contrôle (IPC) et les conjugués anticorps-médicaments (CAM) viennent enrichir le paysage thérapeutique depuis 2016. Avec le CAM enfortumab védotine (EV), une nouvelle norme a pu être établie dans le traitement de première ligne du CUm sur la base de l’étude randomisée de phaseIII EV-302/KEYNOTE-A39.
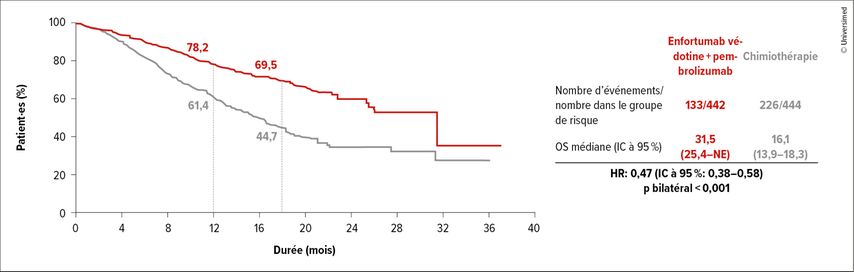
Dans l’étude EV-302/KEYNOTE-A39, les patient·es atteint·es de CU localement avancé/métastatique aptes au traitement par platine ont reçu soit EV plus pembrolizumab (n=442), soit du cisplatine ou du carboplatine plus gemcitabine pendant six cycles (n=444).1 Le pembrolizumab a été administré pendant un maximum de 35 cycles, tandis que l’EV a été administré jusqu’à la progression de la maladie. La survie sans progression (PFS) et la survie globale (OS) constituaient le critère d’évaluation primaire double.
Un bienfait sur le plan de l’OS sans précédent
Le schéma EV plus pembrolizumab a permis de doubler la PFS (12,5 vs 6,3 mois; HR: 0,45; p<0,001) et l’OS (31,5 vs 16,1 mois; Fig.1) par rapport à la chimiothérapie, avec une réduction de la mortalité de 53% (HR: 0,47; p<0,001).1 Lors de la présentation des données de l’étude au congrès ESMO 2023, l’avantage inédit en termes d’OS a été salué par une standing ovation. Les taux de réponse globale étaient de 67,7% vs 44,4% (p<0,001), 29,1% vs 12,5% des patient·es ont obtenu une rémission complète.
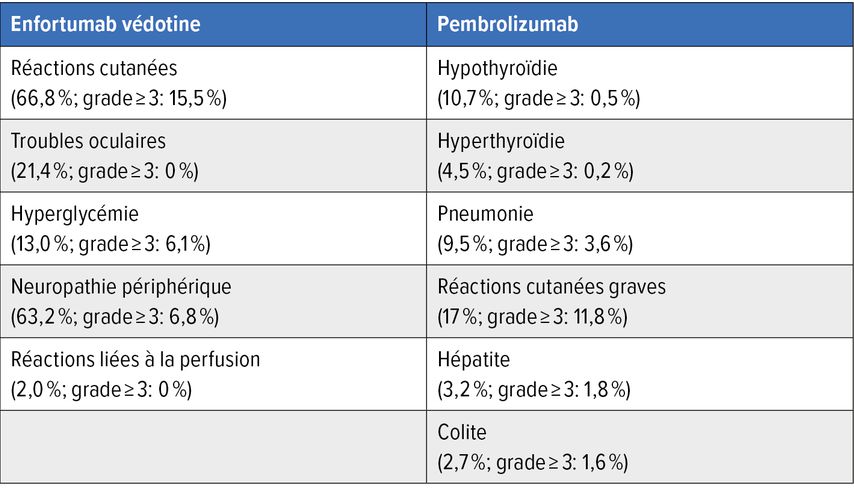
Le traitement par EV s’accompagne d’un éventail d’effets secondaires caractéristiques, comprenant des réactions cutanées, des troubles oculaires, une hyperglycémie, une neuropathie périphérique et des réactions liées à la perfusion (Tab.1). L’association avec le pembrolizumab entraîne un chevauchement dans les réactions cutanées, qui font également partie du profil d’effets indésirables connu de l’IPC.
Tab.1:Evénements indésirables d’intérêt particulier dans l’étude EV-302/KEYNOTE-A39 (modifié selon Powles T et al.)1
Comme mesures générales pour éviter les effets secondaires dermatologiques, il est recommandé aux patient·es de se protéger du soleil, d’utiliser des produits de soins cutanés hypoallergéniques, d’appliquer quotidiennement et à titre préventif des crèmes hydratantes douces et non parfumées et d’éviter les bains et les douches chaudes (surtout en cas de démangeaisons). En cas de troubles oculaires, l’utilisation de larmes artificielles a un effet de soutien.
En ce qui concerne le risque d’hyperglycémie, il est recommandé d’adopter une alimentation équilibrée et de pratiquer une activité physique; en cas d’indication clinique, il convient de procéder à des autocontrôles de la glycémie et à un ajustement médicamenteux. L’obésité et un diabète sucré manifeste font partie des facteurs de risque d’hyperglycémie.
Prise en charge des effets secondaires
Les manifestations dermatologiques associées à l’EV peuvent inclure l’alopécie, la stomatite, les éruptions maculopapuleuses, l’hyperpigmentation et la formation de cloques.2 Les lésions bulleuses doivent inciter à une hospitalisation et à une surveillance afin d’exclure un syndrome de Stevens-Johnson (SJS) ou une nécrolyse épidermique toxique (NET).
Si l’un de ces diagnostics est confirmé, le traitement doit être interrompu de manière permanente. De manière générale, en cas de réactions cutanées, en cas d’aggravation de lésions de grade2 ou d’apparition de fièvre lors de manifestations de grade2 ou 3, il est recommandé d’arrêter le traitement jusqu’à la régression au grade≤1. Ces patient·es sont hospitalisé·es dans notre service; dans tous les cas, une expertise dermatologique est indiquée. La dose peut être maintenue pour les lésions de grade2, tandis que je recommande une réduction au niveau suivant pour les lésions de grade3. En partant de la dose initiale de 1,25mg/kg (maximum 125mg), trois réductions sont possibles par paliers de 0,25mg.
En cas d’hyperglycémie avec des valeurs >250mg/dl, l’administration d’EV doit être interrompue jusqu’à ce qu’elle descende à ≤250mg/dl, puis le traitement peut être poursuivi avec la même dose. L’expérience montre que des réductions de dose sont souvent nécessaires après le contrôle de la glycémie. Les pneumonites/pneumopathies interstitielles nécessitent un arrêt permanent à partir du grade3; en cas de grade2, le traitement doit être interrompu jusqu’à la régression au grade≤1. Par la suite, il est possible soit de maintenir la dose, soit de la réduire d’un palier.
Une neuropathie périphérique de grade2 doit inciter à une pause thérapeutique jusqu’au grade≤1. Lors de la première apparition, le traitement est poursuivi avec la même dose, et en cas de nouvelle manifestation, avec une dose réduite. Les neuropathies de grade≥3 imposent l’arrêt définitif du traitement. En principe, l’objectif est de maintenir les patient·es sous traitement en réduisant les doses, tout en préservant la qualité de vie et la fonctionnalité.
Modifications de l’algorithme
La deuxième étude positive de première ligne présentée au congrès ESMO 2023 était l’étude CheckMate 901, qui portait exclusivement sur des patient·es aptes au traitement par cisplatine.3
Les participant·es étaient randomisé·es pour recevoir soit le nivolumab plus six cycles de cisplatine/gemcitabine, soit la chimiothérapie seule. Le nivolumab a été administré toutes les trois semaines dans le bras expérimental pendant la phase de traitement d’association, puis toutes les quatre semaines pendant la phase de traitement en monothérapie sur une durée allant jusqu’à 24 mois.
CheckMate 901 a également permis d’obtenir un allongement significatif de l’OS dans le bras expérimental, même si celui-ci n’était pas aussi spectaculaire que dans l’étude EV-302/KEYNOTE-A39, avec 21,7 vs 18,9 mois (HR: 0,78; p=0,02). Une réponse a été documentée chez 57,6% vs 43,1%.
Ainsi, l’«ancienne» directive de pratique clinique de l’ESMO sur le traitement du carcinome de la vessie, qui recommandait comme traitement standard de première ligne le cisplatine ou le carboplatine plus la gemcitabine suivi d’une maintenance par avélumab, est maintenant dépassée.4 Dans cette directive, l’EV n’était mentionné qu’en troisième ligne. L’association d’EV et de pembrolizumab constitue désormais la stratégie de première ligne de choix pour l’ensemble des patient·es qui sont en assez bonne forme physique pour recevoir une chimiothérapie et un traitement par IPC (niveau de preuve I, A).5
Si cette option thérapeutique n’est pas accessible ou est contre-indiquée, la nouvelle directive recommande, en cas d’admissibilité au cisplatine, l’association nivolumab et cisplatine/gemcitabine (I, A). Les patient·es aptes à recevoir le carboplatine peuvent être traité·es par carboplatine/gemcitabine suivi d’avélumab (I, A).
Il n’existe actuellement que peu de données sur le traitement séquentiel après la survenue d’une progression sous EV/pembrolizumab. Il est toutefois recommandé de procéder à un séquençage génétique et à un diagnostic élargi avec détermination des altérations pertinentes (p.ex. FGFR, HER2) dès le traitement de première ligne, afin de pouvoir définir les options suivantes en temps voulu.
Littérature:
1 Powles T et al.: Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024; 390(10): 875-88 2 Lacouture ME et al.: Management of dermatologic events associated with the nectin-4-directed antibody-drug conjugate enfortumab vedotin. Oncologist 2022; 27(3): e223-32 3 Van der Heijden MS et al.: Nivolumab plus gemcitabine-cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389(19): 1778-89 4 Powles T et al.: Bladder cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022; 33(3): 244-58 5 Powles T et al.: ESMO Clinical Practice Guideline interim update on first-line therapy in advanced urothelial carcinoma. Ann Oncol 2024; 35(6): 485-90
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...