Stratégies thérapeutiques actuelles pour le cancer du pancréas
Auteur·es:
Dre méd. Louisa Hempel
Dre méd. Saskia Hussung
PD Dr méd. Ralph Fritsch
Klinik für Medizinische Onkologie und Hämatologie
Universitätsspital Zürich
Correspondance:
E-mail: chiaralouisa.hempel@usz.ch
Les adénocarcinomes du pancréas (PC) continuent de représenter undéfi clinique majeur. Les chances de guérison pour les personnes concernées sont faibles, même pour les cancers localisés; l’approche thérapeutique pour le cancer localement avancé et métastatique est palliative. Des progrès importants se dessinent dans le développement de stratégies thérapeutiques multimodales, l’amélioration des options de traitement systémique et le traitement de précision basé sur les anomalies moléculaires.
Keypoints
-
Les PC résécables font l’objet d’une résection primaire; la chimiothérapie néoadjuvante reste controversée.
-
La stratégie néoadjuvante optimale pour les BRPC n’a pas été complètement définie.
-
Le traitement de première ligne par une triple chimiothérapie (FOLFIRINOX) est un traitement de référence important pour les patient·es plus jeunes et en meilleure santé.
-
Le profilage moléculaire des tumeurs et le test de lignée germinale font partie de la norme clinique en matière de PC.
-
Le traitement de précision pour des sous-groupes moléculaires définis élargit les options thérapeutiques en cas de PC.
Cancers du pancréas résécables
La résécabilité anatomique des cancers du pancréas est évaluée en préopératoire par TDM-IRM. Cela se fait selon les critères du National Comprehensive Cancer Network (NCCN), modifiés selon les directives de l’International Academy of Pathology (IAP). Il s’agit d’évaluer la position anatomique de la tumeur par rapport aux structures artérielles et veineuses majeures – le tronc cœliaque et ses branches, l’artère mésentérique supérieure et le système porte. Les tumeurs résécables ne doivent présenter aucun contact avec les artères susmentionnées, tout au plus un contact veineux minimal.1 En outre, l’exclusion de métastases à distance est obligatoire lors de la décision d’une résection. Le traitement de référence des cancers du pancréas résécables reste la résection primaire, suivie d’une chimiothérapie adjuvante par FOLFIRINOX modifié (5-FU, leucovorine, irinotécan, oxaliplatine), sur la base des données de l’étude PRODIGE-24.2
L’intérêt d’un traitement néoadjuvant est discuté depuis longtemps. Cette question est actuellement examinée par l’étude américaine Alliance-A021806.3 Une étude de phase II randomisée scandinave à petite échelle (NORPACT-1) a été présentée récemment.4 Elle n’a montré aucun avantage du traitement néoadjuvant, mais elle a été critiquée en raison d’une dose-densité remarquablement faible dans le bras néoadjuvant. Un traitement néoadjuvant des cancers du pancréas résécables est déconseillé dans la nouvelle directive de l’European Society for Medical Oncology (ESMO).5 En revanche, les directives actuelles du NCCN6 recommandent une chimiothérapie néoadjuvante comme alternative à la résection primaire, ce qui indique des différences importantes dans le traitement de référence des deux côtés de l’Atlantique.
BRPC
Les «Borderline Resectable Pancreatic Cancer» (BRPC) ne doivent jamais faire l’objet d’une résection primaire.5,6 Les données étant insuffisantes, il n’y a toutefois guère de consensus sur la détermination optimale du traitement préalable. L’étude de phase II randomisée ESPAC-5 a montré un avantage du traitement néoadjuvant par rapport à la résection immédiate.7 Toutefois, le faible nombre de cas ne permet pas de comparer les différents protocoles néoadjuvants (FOLFIRINOX, gemcitabine plus capécitabine, chimioradiothérapie).
Dans les études néerlandaises de phase III PREOPANC8 et PREOPANC-2,9 les PC résécables et les BRPC ont été étudiés ensemble, ce qui limite la pertinence des résultats de façon générale. Dans l’étude PREOPANC-2, aucun avantage d’un traitement néoadjuvant par FOLFIRINOX par rapport à une chimioradiothérapie néoadjuvante à base de gemcitabine n’a été constaté dans ce contexte, la conception de l’étude ayant également été critiquée en raison de la faible dose-densité dans le bras sous FOLFIRINOX (8 cycles maximum, aucun traitement adjuvant).
Cancer du pancréas localement avancé et métastasique
Le traitement systémique des PC avancés n’a guère évolué ces dernières années. Une chimiothérapie combinée, soit par FOLFIRINOX, soit par l’association gemcitabine/nab-paclitaxel, est toujours recommandée pour les patient·es dont le statut de performance ECOG est compris entre 0 et 1. FOLFIRINOX est généralement privilégié par les directives pour le traitement de première ligne chez les patient·es avec un bon statut ECOG.10 L’association gemcitabine/nab-paclitaxel est une bonne alternative en première ligne pour les patient·es âgé·es ou souffrant de maladies concomitantes du fait de son profil de toxicité différent et plus faible dans la pratique clinique quotidienne que celui de FOLFIRINOX.
L’étude de phase III NAPOLI-3, récemment publiée, a montré une prolongation de la survie globale dans une population non présélectionnée sur le plan moléculaire sous la trithérapie NALIRIFOX, développée sur la base de FOLFIRINOX, par rapport à l’association gemcitabine/nab-paclitaxel.11 Ces données soulignent certes la supériorité d’une trithérapie de première ligne par rapport à une bithérapie, mais l’utilisation clinique de NALIRIFOX est perçue comme obsolète en raison de l’absence de supériorité par rapport au FOLFIRINOX conventionnel dans la comparaison transversale, tout en présentant des coûts bien plus élevés. Pour les traitements de deuxième et troisième ligne, les directives actuelles recommandent de changer de chimiothérapie en fonction du traitement choisi en première ligne.5
Traitement de précision des cancers du pancréas
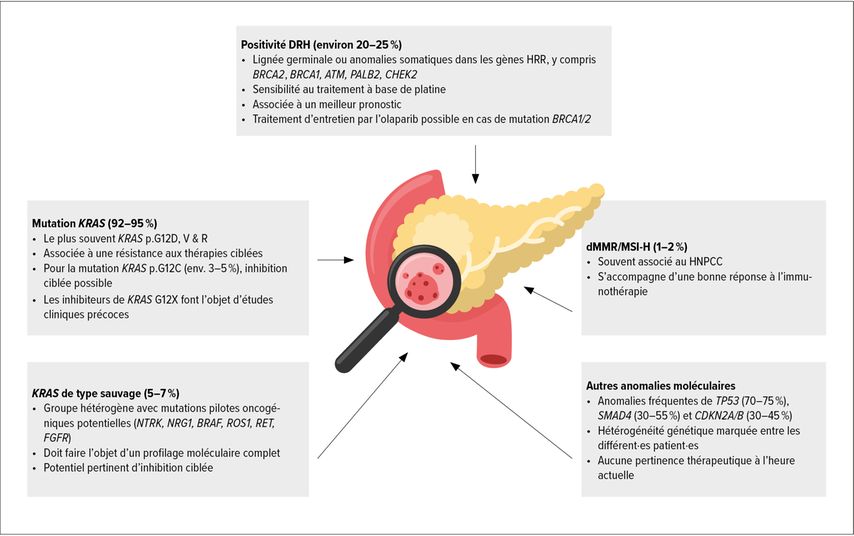
Des progrès importants ont été réalisés dans le traitement de précision de sous-groupes moléculaires définis de PC (Fig. 1). Parallèlement, le développement de thérapies ciblées sur le plan moléculaire, en particulier l’inhibiteur de la voie de signalisation KRAS, présente un grand potentiel pour le traitement du PC. En conséquence, les directives du NCCN et de l’ESMO recommandent désormais le profilage moléculaire des tumeurs pour tous·tes les patient·es atteint·es de PC avancé.5,6 En outre, l’ensemble des patient·es devraient subir un test de lignée germinale pour BRCA1 et BRCA2.
Fig. 1: Sous-groupes moléculaires du cancer du pancréas. Les mutations du gène KRAS sont caractéristiques de l’adénocarcinome canalaire du pancréas (PC). Cependant, d’autres anomalies importantes pour la thérapie sont de plus en plus souvent identifiées (modifié d’aprés Akhoundova D et al.)17
Cancers du pancréas HRD
Les anomalies moléculaires les plus fréquentes ayant des conséquences thérapeutiques dans le PC sont des anomalies au niveau des voies de signalisation HRR («homologous recombination repair»). Les cancers du pancréas HRD («homologous recombination deficiency», HRD-PC) présentent une très grande sensibilité au platine et doivent être traités en première ligne par une chimiothérapie à base de platine. Cela implique que le test moléculaire doit être effectué si possible avant l’instauration du traitement de première ligne, surtout si un traitement sans platine est prévu.5
En cas de PC avec mutation BRCA1/2, un traitement d’entretien par l’olaparib basé sur l’étude POLO est également possible.12
Cancers du pancréas KRAS de type sauvage
Le deuxième groupe important est celui des 5 à 7% de tous les PC sans mutation KRAS (KRAS-WT-PC). Dans ces cancers, on trouve parfois des mutations pilotes oncogéniques rares pouvant être traitées. Elles peuvent par exemple comprendre des mutations BRAF de classe 2 ainsi que des réarrangements génomiques dans les gènes NTRK, NRG1, BRAF, ROS1, RET et FGFR. Les KRAS-WT-PC devraient donc toujours faire l’objet d’une analyse génomique complète.10
Thérapies ciblant le gène KRAS
Les mutations activatrices du gène KRAS sont les anomalies génomiques les plus fréquentes dans le PC. Actuellement, une thérapie ciblée par le sotorasib peut être proposée aux patient·es présentant la mutation ponctuelle spécifique KRAS p.G12C (incidence PC: 2–3%). L’efficacité du sotorasib en cas de mutation KRAS p.G12C confirmée a été démontrée dans l’étude de phase I/II CodeBreaK 100. En outre, l’adagrasib a été étudié dans l’étude de phase II KRYSTAL-1.13,14
De nouvelles données d’étude sur le premier inhibiteur Pan-RAS, qui pourrait être utilisé dans d’autres mutations ponctuelles du gène KRAS, ont été présentées lors du congrès de l’ESMO 2023. L’étude de phaseI RMC-6236-001 a évalué la substance à l’étude RMC-6236, entre autres, chez 46 patient·es atteint·es de PC présentant des mutations KRAS p.G12X qui ont reçu un traitement préalable intensif.15 Un taux de réponse global (ORR) de 20% et un taux de contrôle de la maladie (DCR) de 87% ont été rapportés. De nombreux autres nouveaux inhibiteurs de KRAS et la transmission du signal dépendante de KRAS font l’objet d’études cliniques précoces, l’inhibition de KRAS étant certainement le nouveau développement le plus intéressant à l’heure actuelle dans le traitement du PC.
Cancers du pancréas MSI-H
Les PC dMMR («deficient mismatch repair») et MSI («microsatellite instability») sont rares (environ 1%), mais très importants sur le plan thérapeutique. Ils présentent une très grande sensibilité aux inhibiteurs de point de contrôle anti-PD-1/PD-L1. Une étude de cohorte multinationale récemment publiée le souligne clairement.16 Dans la pratique clinique, il est important de ne pas négliger ces quelques patient·es et de leur proposer systématiquement une immunothérapie.
Littérature:
1 Kwaśniewska D et al.: How a patient with resectable or borderline resectable pancreatic cancer should be treated—a comprehensive review. Cancers (Basel) 2023; 15(17): 4275 2 Conroy T et al.: FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med 2018; 379(25): 2395-406 3 Chawla A et al.: Alliance A021806: a phase III trial evaluating perioperative versus adjuvant therapy for resectable pancreatic cancer. J Clin Oncol 2023; 41(16_suppl): TPS4204 4 Labori KJ et al.: Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: a multicenter randomized phase-II trial (NORPACT-1). J Clin Oncol 2023; 41(17_suppl): LBA4005 5 Conroy T et al.: Pancreatic cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(11): 987-1002 6 Tempero MA et al.: Pancreatic adenocarcinoma, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2021; 19(4): 439-57 7 Ghaneh P et al.: Immediate surgery compared with short-course neoadjuvant gemcitabine plus capecitabine, FOLFIRINOX, or chemoradiotherapy in patients with borderline resectable pancreatic cancer (ESPAC5): a four-arm, multicentre, randomised, phase 2 trial. Lancet Gastroenterol Hepatol 2023; 8(2): 157-68 8 Versteijne E et al.: Neoadjuvant chemoradiotherapy versus upfront surgery for resectable and borderline resectable pancreatic cancer: long-term results of the Dutch randomized PREOPANC trial. J Clin Oncol 2022; 40(11): 1220-30 9 Janssen QP et al.: Total neoadjuvant FOLFIRINOX versus neoadjuvant gemcitabine-based chemoradiotherapy and adjuvant gemcitabine for resectable and borderline resectable pancreatic cancer (PREOPANC-2 trial): study protocol for a nationwide multicenter randomized controlled trial. BMC Cancer 2021; 21: 300 10 Conroy T et al.: Pancreatic cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(11): 987-1002 11 Wainberg ZA et al.: NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet 2023; 402(10409): 1272-81 12 Kindler HL et al.: Overall survival results from the POLO trial: a phase III study of active maintenance olaparib versus placebo for germline BRCA-mutated metastatic pancreatic cancer. J Clini Oncol 2022; 40(34): 3929-39 13 Strickler JH et al.: Sotorasib in KRAS p.G12C–mutated advanced pancreatic cancer. NEngl J Med 2023; 388(1): 33-43 14 Bekaii-Saab TS et al.: KRYSTAL-1: Updated activity and safety of adagrasib (MRTX849) in patients (pts) with unresectable or metastatic pancreatic cancer (PDAC) and other gastrointestinal (GI) tumors harboring a KRAS G12C mutation. J Clin Oncol 2022; 40(4_suppl): 519 15 Sacher A et al.: Single-agent divarasib (GDC-6036) in solid tumors with a KRAS G12C mutation. N Engl J Med 2023; 389(8): 710-21 16 Taïeb J et al.: Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repair-deficient advanced pancreatic adenocarcinoma: an AGEO European Cohort. Eur J Cancer 2023; 188: 90-7 17 Akhoundova D et al.: Precision oncology for hepato-pancreato-biliary (HPB) cancers state of the art and future directions. healthbook TIMES Oncology Hematology 2020; 5(3): 52-9
Das könnte Sie auch interessieren:
Le symposium «ASCO Genitourinary Cancers Symposium» fête son 20e anniversaire
Avec 5200inscriptions et 877résumés soumis, le symposium «ASCO Genitourinary Cancers Symposium» (ASCO GU) a fêté son 20eanniversaire au début de cette année. DrEric Small, président lors ...
La sélection est essentielle dans le traitement des tumeurs gastro-intestinales
La différenciation moléculaire au sein des entités tumorales a conduit à de nouvelles options thérapeutiques, en particulier en ce qui concerne les stratégies thérapeutiques ciblées. L’ ...
Nouveaux traitements de référence, thérapies combinées et séquençage optimal
L’European Lung Cancer Congress (ELCC) s’est tenu à Prague du 20 au 23 mars. Cette année encore, l’accent a été principalement mis sur les immunothérapies et les thérapies ciblées. Ci- ...