Die häufigsten Knochentumoren der oberen Extremität im Kindes- und Jugendalter und ihre Behandlung
Autoren:
Prof. Dr. Andreas H. Krieg1
Dr. Alexandre Kämpfen1,2
1 Kinderorthopädische Universitätsklinik, Universitätskinderspital beider Basel (UKBB) und Knochen- und Weichteiltumorzentrum der Universität Basel (KWUB)
2 Plastische, Rekonstruktive, Ästhetische und Handchirurgie, Universitätsspital Basel
Korrespondierender Autor:
Prof. Dr. Andreas H. Krieg
E-Mail: andreas.krieg@ukbb.ch
In diesem Artikel stellen wir die häufigsten Knochentumoren an der oberen Extremität von Kindern und Jugendlichen bis 18 Jahre vor. Aktuelle Zahlen aus dem nationalen Knochentumor-Referenzzentrum der Schweiz sowie Klinik, Diagnostik und verschiedene Behandlungsoptionen der häufigsten benignen und malignen Tumoren an der oberen Extremität bei Kindern und Jugendlichen werden dargestellt.
Keypoints
-
Die häufigsten gutartigen Knochentumoren an der oberen Extremität sind Osteochondrome und solitäre Knochenzysten. Bei den malignen Knochentumoren ist es das Osteosarkom. Die häufigste Lokalisation ist hier die Metaphyse am proximalen Humerus.
-
Schmerzen an der oberen Extremität bei Kindern und Jugendlichen sollten diagnostisch nachverfolgt werden, da „Wachstumsschmerzen“ an der oberen Extremität nicht bekannt sind!
-
Osteochondrome sollten operativ rechtzeitig angegangen werden, vor allem am Vorderarm, wo sie entsprechende Wachstumsstörungen und somit Funktionsbeeinträchtigungen verursachen können.
-
Rekonstruktionen bei pädiatrischen malignen Knochentumoren des Oberarms oder Vorderarms sollen die Platzierung der Hand im Raum optimieren. Angesichts der Langlebigkeit der Sarkomüberlebenden ist die Langlebigkeit der Rekonstruktion ein wichtiger Planungsaspekt. Biologische Rekonstruktionen, die autologen/vaskularisierten Knochen mit Sehnenrepair und -transfers kombinieren, scheinen hierfür am besten geeignet und sind wann immer möglich einer Prothese vorzuziehen.
-
Eine interdisziplinäre Zusammenarbeit mit einem erfahrenen plastischen/Handchirurgen ist hierfür aus onkologischer orthopädischer Sicht unabdingbar.
Definition
Der Artikel umfasst Knochentumoren, die ihren Ursprung am Knochen der oberen Extremität haben, zu welchen definitionsgemäß der Humerus, der Vorderarm mit Radius und Ulna sowie die Hand mit den Handwurzelknochen, Metacarpalia und Phalangen gehören.
Vorkommen
Die hier aufgeführte Liste und Gewichtung ist eine Zusammenstellung anhand unseres nationalen Knochentumor-Referenzzentrums vom März 2022 und nicht epidemiologisch begründet.
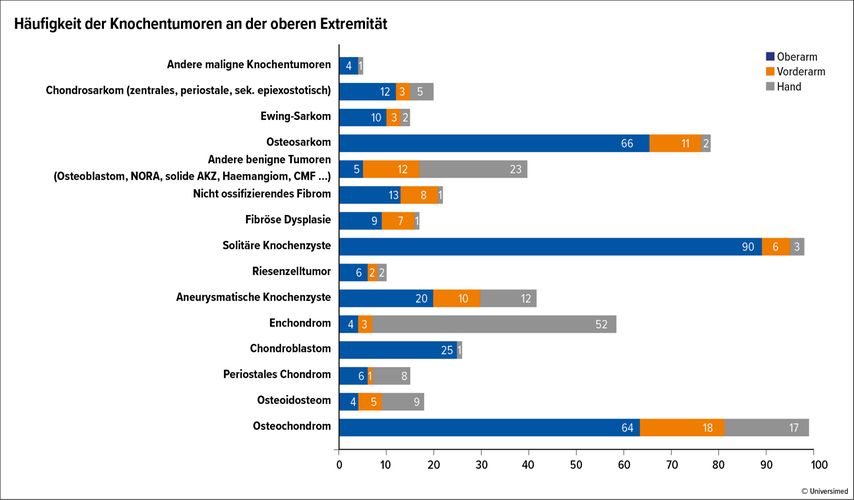
Die häufigsten benignen Knochentumoren an der oberen Extremität sind das Osteochondrom und die solitäre Knochenzyste, wobei Letztere die häufigste am proximalen Humerus ist (Abb. 1). Die solitäre Knochenzyste ist wesentlich häufiger vertreten als nachgewiesen, da diese Läsion meist nicht biopsiert und oft konservativ therapiert wird. Im Vergleich zur unteren Extremität sind die nicht ossifizierenden Knochenfibrome an der oberen Extremität eine Rarität, wobei hier die Dunkelziffer in der weniger biomechanisch belasteten Region deutlich höher liegen muss.
Abb. 1: Häufigkeit und Lokalisation von malignen und benignen Knochentumoren an der oberen Extremität: Humerus, Unterarm (Radius und Ulna) und Hand (Handwurzelknochen, Metacarpalia und Phalangen) – aktuelle Daten aus dem Nationalen Knochentumor-Referenzzentrum (KTRZ) der Universität Basel (Leiter: Prof. Dr. Daniel Baumhoer)
Am Humerus finden sich recht häufig das Chondroblastom und die aneurysmatische Knochenzyste. An der Hand ist das Enchondrom der dominante Knochentumor, vor allem an den Phalangen. Es finden sich hier aber auch Osteochondrome und aneurysmatische Knochenzysten. Am Vorderarm fanden sich die wenigsten Knochentumoren in unserem Register. Auch hier sind die Osteochondrome die häufigste gutartige Tumorart, welche fast immer zu Wachstumsstörungen führt (Abb. 3a).
Bei den malignen Knochentumoren ist das Osteosarkom der häufigste Knochentumor, welcher sich vor allem am proximalen Humerus findet. In unserem Register ist der zweithäufigste maligne Knochentumor das Chondrosarkom, knapp gefolgt vom Ewing-Sarkom, das vor allem an der Diaphyse des Humerus anzutreffen ist. Wenn man das gesamte Skelett betrachtet, ist das Ewing-Sarkom normalerweise die Nummer 2 bei Kindern und Jugendlichen.1 Andere maligne Knochentumoren sind extrem rar und treten nur in Einzelfällen an der oberen Extremität auf (Abb. 1). An der Hand sind maligne Tumoren noch seltener als an der übrigen oberen Extremität. Der Riesenzelltumor soll als intermediärerTumor herausgestellt werden, da er im Falle einer seltenen ossären Ausprägung im Bereich des Handgelenks und der Metacarpalia einer multimodalen Therapie bedarf.
Klinik/Diagnostik
Anders als an der unteren Extremität sind unspezifische Schmerzen bei Kindern an der oberen Extremität eine Seltenheit und sollten von uns ernst genommen werden. Einzig Handgelenksschmerzen können gelegentlich ohne Pathologie in dieser Altersgruppe auftreten, wobei auch hier oft ein kleineres Trauma als Ursache zu finden ist. Wachstumsschmerzen, die an der unteren Extremität häufig auftreten, sind uns an der oberen Extremität nicht bekannt.2 Nachtschmerzen oder lokalisierte Schmerzen an der oberen Extremität finden sich unter den benignen Tumoren nur bei den selteneren Osteoidosteomen, periostalen Chondromen und Osteoblastomen sowie bei den malignen Tumoren beim Osteosarkom. Somit ist bei Schmerzen an der oberen Extremität bei Kindern und Jugendlichen ein Röntgenbild in zwei Ebenen anzufertigen und immer zu rechtfertigen.
Knochenzyste
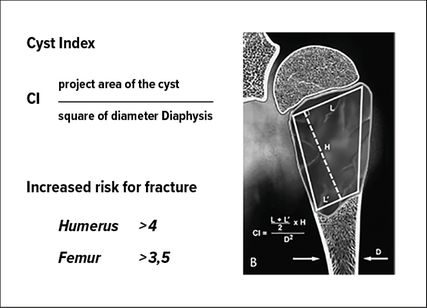
Abb. 2: Kaelin und MacEwen stellten fest, dass je größer die Zyste war, desto mehr Kortikalis zerstört und der Knochen geschwächt war.6 Um die Stärke der verbleibenden Kortikalis, die von der Größe der Zyste und der Größe des betroffenen Knochens abhängt, zu quantifizieren, entwickelten sie den Zystenindex. Dieser gibt das Verhältnis zwischen der röntgenologischen Fläche der Zyste und der Größe des betroffenen Knochens an, gemessen als Durchmesser der Diaphyse zum Quadrat
Die meisten Tumoren an der oberen Extremität werden als Zufallsbefunde oder beim Auftreten einer pathologischen Fraktur diagnostiziert. Dies gilt insbesondere für die solitäre Knochenzyste, die gehäuft am proximalen Humerus lokalisiert ist.3 Sie wird in den alten Lehrbüchern immer noch als selbstlimitierende tumorähnliche Läsion anerkannt, welche in der Regel keine Behandlung benötigt, nach einer Fraktur selbst konsolidiert oder spätestens bis zum Wachstumsabschluss dann ossifiziert.2 Alle Läsionen, die bisher unter „Tumoren undefinierter neoplastischer Natur“ aufgeführt waren, werden nun seit 2020 mit der neuen WHO-Klassifikation als echte Neoplasmen betrachtet.4 Als Beispiel gilt die einfache Knochenzyste, bei der eine wiederkehrende Translokation des NFATC2-Gens festgestellt wurde, deren Bedeutung noch nicht bekannt ist.5
Das einfache Röntgenbild lässt bei einem Zufallsbefund einer solitären Knochenzyste mittels des Zystenindex6 ein Frakturrisiko abschätzen (Abb. 2).
Osteochondrome
Osteochondrome am Oberarm werden vor allem bei der proximalen posteromedialen Lokalisation erst ab einer gewissen Größe bemerkt, da es hier bei Rotationsbewegungen der Schulter oder auch bei Adduktion zur Irritation der Nerven aus dem Plexus brachialis kommen kann. Im Vordergrund steht aber oft nur die tastbare, knochenharte „Vorwölbung“, die der Patient und der Arzt spüren können.
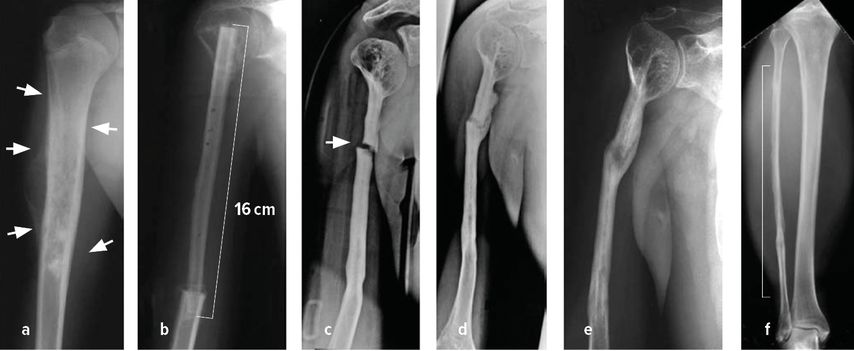
Am Vorderarm verursachen die Osteochondrome in 30–60% der Fälle signifikante Wachstumsstörungen (Abb. 3a).7–9 Insbesondere eine Einschränkung der Umwendbewegung durch dieses Fehlwachstum oder die Tumoren selbst stellt eine wesentliche Beeinträchtigung der Handfunktion dar. Glücklicherweise sind die meisten Befunde solitär und betreffen den Radius epimetaphysär. Etwa 15% aller Osteochondrome kommen im Kontext einer multiplen hereditären Exostosenkrankheit vor. Der dann beidseitige Befall verschlimmert den funktionellen Verlust. 1% aller Osteochondrome degeneriert zu malignen Formen, meist zu Chondrosarkomen. Meist betrifft dies stammnahe Tumoren und nicht Vorkommen am Arm.10
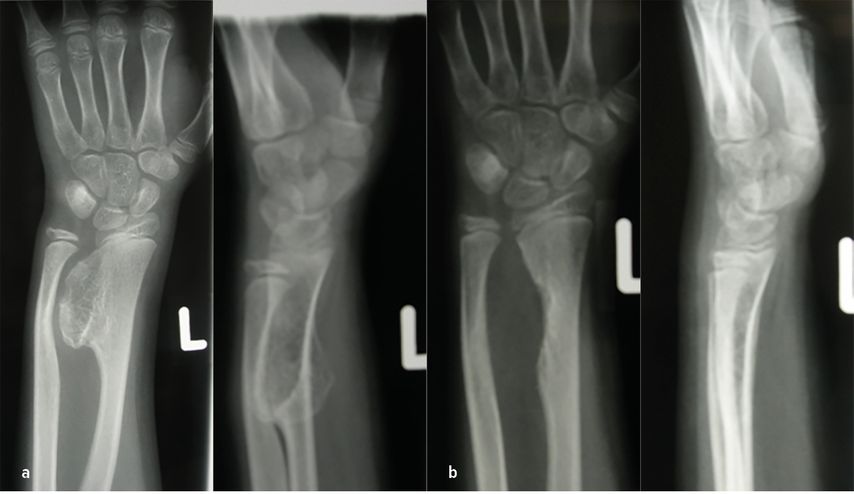
Abb. 3: a) 10-jähriges Mädchen mit zunehmender Deformität und Schmerzen im Handgelenk links, verursacht durch ein großes Osteochondrom am Radius, die Ulna verdrängend (Massada Typ III); b)3 Monate später nach alleiniger Resektion bereits Normalisierung der Achsen- und Gelenkverhältnisse
Osteochondrome wurden früher nach Massada eingeteilt.11 Die Massada-Klassifikation deckt nur einen Teil der möglichen Deformitäten am Vorderarm ab und ist nicht validiert. Jos Klassifikation adressiert auch den wichtigen beidseitigen Osteochondrombefall am distalen Vorderarm und ist so als Klassifikation besser geeignet.12 Trotzdem wird auch diese Klassifikation unter Experten nur mit einer moderaten bis fairen Reliabilität beurteilt.13 An der Hand können die Osteochondrome durch die Vorwölbung zu schnappenden Sehnen, Über- und Unterkreuzen der Finger und Nageldeformitäten führen.
Enchondrome
Auch Enchondrome, die häufigsten Knochentumoren an der Hand überhaupt, führen zu einer Auftreibung der Phalangen, im Jugendalter gelegentlich auch zu pathologischen Frakturen. Schmerzen bereiten sie in der Regel jedoch keine! Im Zusammenhang mit dem Maffucci-Syndrom oder der Ollier-Erkrankung treten diese Tumoren insbesondere an der Hand gehäuft auf. Die in diesen Fällen häufiger auftretenden pathologischen Frakturen helfen bei der frühen Diagnosestellung.
Therapie
Benigne Knochentumoren
Ostochondrome
Die meisten Osteochondrome an der oberen Extremität werden gleich wie am Rest des Skeletts behandelt. Eine Exzision ist nur bei Schmerz oder funktioneller Einschränkung zu rechtfertigen, da es sich um eine selbstlimitierende Erkrankung handelt.14
Am Vorderarm treten gehäuft Einschränkungen der Umwendbewegung aufgrund der Osteochondrome auf. Es besteht immer noch eine Kontroverse darüber, ob es zu rechtfertigen ist, präventiv Osteochondrome zu entfernen, um dies zu verhindern. Insbesondere eine Verkürzung der Vorderarmknochen könnte durch Verlängerung behoben werden.15 In unserer Serie von 17 Vorderarmen bei 15 Patienten mit einer Nachverfolgungszeit von 20 Jahren wurden 4 Extremitäten nur beobachtet und 13 wurden operiert. Bei etwa 1/3 der Patienten wurden nur die Osteochondrome entfernt, bei den anderen gleichzeitig auch eine Begradigung oder Verlängerung der Knochen vorgenommen. Nach 20 Jahren zeigte sich, dass die Handgelenks- und Ellenbogenbeweglichkeit bei der Gruppe, die lediglich einer Tumorexzision unterzogen wurde, in 85% der Fälle eine Verbesserung erfuhr, während die Gruppe mit gleichzeitiger Verlängerung aufgrund zweier steifer Ellenbogen nur in knapp 70% eine Verbesserung der Beweglichkeit verzeichnete. Außerdem war die Unterarmverlängerung unabhängig vom verwendeten Fixateur mit erheblichen Komplikationen behaftet. 4 von 6 Patienten benötigten ungeplante Reoperationen. Die Gruppe ohne chirurgische Therapie hatte sowohl funktionale wie auch kosmetische Defizite, die schwerwiegender waren als bei den Patienten, die einer Operation unterzogen wurden.
Aufgrund dieser Erfahrung haben wir uns dazu entschieden, Osteochondrome am Vorderarm frühzeitig zu entfernen, bevor funktionelle Defizite auftreten (Abb. 3). Verlängerungsoperationen werden nur bei drohender Luxation des Radiusköpfchens in Erwägung gezogen, da diese die Umwendbewegung unwiederbringlich verunmöglicht und eine Radiusköpfchenresektion im Langzeitverlauf eine Ulnaimpaktion im Karpus zur Folge haben kann (Abb. 7)
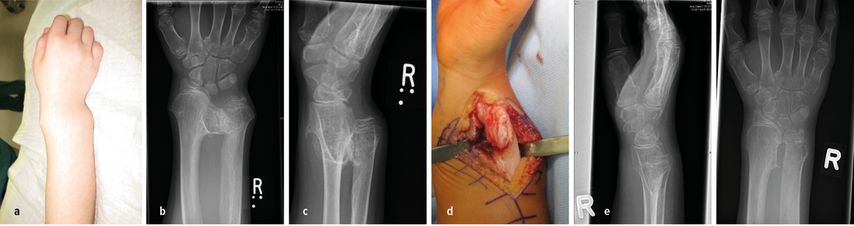
Abb. 7: a–c) Entfernung großer Osteochondrome am Handgelenk rechts mit aufgehobener Supination (dominant); d) intraoperativ; e) Resultat 6Wochen postoperativ mit wiederhergestellter Umwendbewegung und Kongruenz im distalen Radioulnargelenk
In Analogie ist das Vorgehen an den Fingern zu empfehlen. Störende Tumoren, die zu Fehlwachstum mit Beeinträchtigung der Fingerfunktion (auch des Nachbarfingers) führen, werden frühzeitig entfernt.
An Endphalangen können durch eine rechtzeitige Tumorexzision das Nagelwachstum normalisiert und die Schmerzen zuverlässig behandelt werden.
Solitäre Knochenzyste
In der Regel zeigt sich eine solche Zyste im Rahmen einer pathologischen Fraktur an der oberen Extremität. Sie kann dann entweder konservativ mit Ruhigstellung in einer Orthese oder mit intramedullärer Osteosynthese stabilisiert werden.16 Nach eigener Beobachtung verschwindet in einem Drittel der Fälle solch eine Zyste nach der Frakturheilung. Persistierende Zysten können dann mit dem Wachstumsabschluss resorbieren (in 80% der Fälle) oder asymptomatisch als Residualzyste verbleiben. Problematisch wird es, wenn die Zyste im Kindesalter weiter an Größe zunimmt und eine weitere Fraktur droht: Mit dem Zystenindex kann ein Frakturrisiko abgeschätzt werden (Abb. 2). Bei erhöhtem Risiko empfiehlt sich die präventive Stabilisierung in Form einer aufwendigeren Kürettage und ggf. Auffüllung mit autologem Material17 oder die perkutane Zystenaspiration und Auffüllung mit einem bioresorbierbaren Knochenersatzstoff (Abb. 6).18 Es gilt hier für uns, eine erneute Traumatisierung nicht nur des Knochens, sondern auch des jungen Patienten zu vermeiden. Da sowohl aufwendigere Verfahren als auch perkutane, minimal invasive Verfahren ähnlich gute Resultate aufweisen, rechtfertigt sich bei einem benignen ggf. selbstlimitierenden Tumor wie die solitäre Zyste für uns das minimal invasivere Vorgehen.
Abb. 6: a) 11-jähriges Mädchen mit solitärer Knochenzyste, symptomatisch vermutlich wegen Stressfraktur und erhöhten Frakturrisikos; b,c) Indikation zur perkutanen Zystenaspiration und Auffüllung mit bioresorbierbarem Knochenzement (4Wochen postoperativ) d) 2-Jahres-Verlaufskontrolle mit verdickter Kortikalis und Rezidivfreiheit
Enchondrom
Enchondrome kommen an der gesamten oberen Extremität vor. An den Fingern und auch Metacarpalia werden sie oft nur durch ein Bagatelltrauma mit übermäßigen Schmerzen und entsprechendem Röntgen diagnostiziert. Eine Behandlung erübrigt sich häufig, da durch den meist möglichen konservativen Heilungsprozess der Fraktur, z.B. in einer Schiene, eine suffiziente Auffüllung/Ausheilung vorkommen kann.2
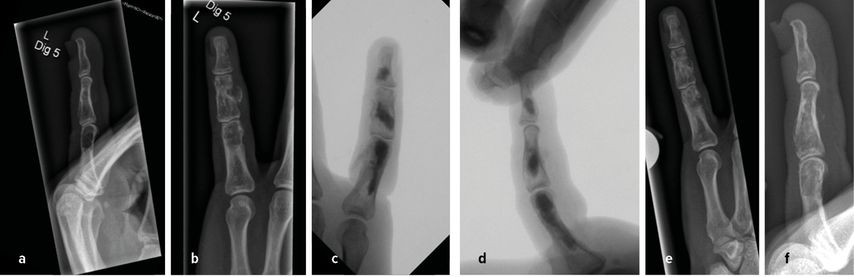
Bei rezidivierenden Traumata oder großen Befunden sind eine Kürettage und das Auffüllen mit autologem spongiösem Knochen oder Ersatzmaterial empfehlenswert (Abb. 8). Mechanisch instabile Situationen benötigen selten eine Osteosynthese, sei es durch interne oder externe Verfahren. Größenprogrediente Befunde, z.B. bei Ollier-Patienten, sollten zur Dignitätsklärung in Form von einer „Kuropsie“ diagnostisch ausgeräumt werden.
Abb. 8: Auffüllung von multiplen Enchondromen mit Cerament jeweils seitlich und dorsopalmar; a,b) präoperativ; c,d) intraoperativ; e,f) 6 Wochen postoperativ
Übrige
Die aggressiveren gutartigen Tumoren (aneurysmatische Knochenzyste, periostale Chondrome, Riesenzelltumor) können in der Regel mit einer aggressiven Kürettage oder en-bloc reseziert werden. Eine biologische Überbrückung/Auffüllung mit einem vaskularisierten/nicht vaskularisierten Autograft ist in der Regel ausreichend. Bei der aneurysmatischen Knochenzyste können weiter neoadjuvante Therapieoptionen (Kryotherapie, Sklerotherapie oder radionuklide Ablation) diskutiert werden.19 Bei artikulärer Beteiligung kann ein osteoartikulärer Allograft aufgrund der geringen biomechanischen Belastung im Vergleich zur unteren Extremität lange gut funktionieren, bevor eine Arthrodese wegen möglicher sekundärer Arthoseveränderungen notwendig wird.
Maligne Knochentumoren
Bei Sarkomen der oberen Gliedmaßen steht das Operationsteam vor der Herausforderung, ausreichende Resektionsränder und gleichzeitig eine zuverlässige und dauerhafte Rekonstruktion zu garantieren. Angesichts der räumlichen Beschränkungen der Anatomie von Kindern sind mehrere Zentimeter breite Ränder um den Tumor herum nicht möglich. Daher ist es sehr wichtig zu verstehen, welche Gewebeebenen zuverlässige Tumorbarrieren sind und wie einzelne Muskeln innerviert und von Gefäßen versorgt werden, um eine rationale und sichere Resektion zu planen. Der nächste wichtige Aspekt der Sarkomchirurgie im Bereich der Schulter und des Oberarmknochens ist der Erhalt oder die Wiederherstellung der Handfunktion. Schließlich ist die Optimierung der Schulter- und Ellenbogenfunktion das dritte große Ziel.
Der proximale Humerus ist der häufigste Ort für primär bösartige Tumoren im Bereich der Schulter. In unserer Datenbank ist es das Osteosarkom. Die meisten pädiatrischen Fälle erfordern eine intraartikuläre oder extraartikuläre Resektion des proximalen Oberarmknochens, erfordern aber oft keine En-bloc-Resektion des Schulterblatts und des lateralen Schlüsselbeins oder anderer Varianten des erweiterten Tikhoff-Linberg-Ansatzes.20 Obwohl zahlreiche Optionen zur Rekonstruktion des proximalen Humerusdefekts beschrieben wurden, fallen die meisten von ihnen in eine von zwei Kategorien: glenohumerale Fusion oder mobile glenohumerale Rekonstruktion. Die vielleicht wichtigste Überlegung ist, ob ein funktionierender Deltamuskel erhalten werden kann, einschließlich des Nervus axillaris und eines Großteils des Muskels.
In Fällen, in denen ein funktionierender Deltamuskel nicht erhalten werden kann, bietet die skapulohumerale Fusion eine bessere Funktion im Vergleich zur Aufhängung einer Art von Humerusersatz am Glenoid, Schlüsselbein oder an den Rippen.21,22 Bei einer Fusion wird eine thorakohumerale Elevation von mindestens 30° durch die periskapulären Muskeln, einschließlich des oberen Trapezius, erhalten. Einige Kinder können eine scheinbare Flexion und Abduktion von annähernd 90° durch adaptive Manöver erreichen, indem sie ihre Wirbelsäule seitlich krümmen.
Allograft ist ein traditionelles Material, um eine Fusion zu erreichen. Im Vergleich zur Verwendung einer isolierten vaskularisierten Fibula können Komplikationen wie Resorption, Frakturen und Infektionen durch ein Verbundtransplantat (das Einschieben einer freien vaskulären Fibuladiaphyse an den Peronealgefäßen)21 reduziert oder möglicherweise ganz vermieden werden.23
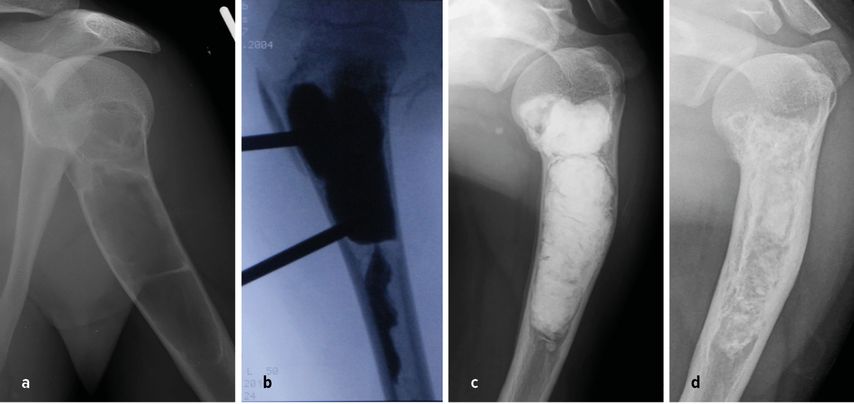
Alternative Optionen für die kurzstreckige Fusion sind ein gestieltes laterales skapuläres Säulentransplantat, ergänzt durch Allograft-Knochen,24 oder die Clavikula-pro-humero-Aufhängung.25 Das Schlüsselbein wird dafür medial geteilt und nach unten gedreht, um mit dem Oberarmknochen zu verschmelzen, wodurch die obere Extremität am Akromioklavikulargelenk aufgehängt wird (Abb. 5). Die Länge der Lücke, die wiederhergestellt werden kann, ist bei skelettreifen Personen auf etwa 12 cm begrenzt und eine Nonunion kann ein Problem sein, dafür ist aber eine gute Funktion mit 30–90° Elevation bei intaktem Deltamuskel möglich. Diese letzte Option ist besonders nützlich für den ungewöhnlichen Fall, dass der Deltamuskel, aber nicht das Glenoid und der Skapulahals geschont werden können.26
Abb. 5: a) 13-jähriger Junge mit einem High-Grade-Osteosarkom am proximalen Humerus links (Röntgen und MRI); b) Nach neoadjuvanter Chemotherapie erfolgten die weite Resektion des gesamten proximalen Humerus (R0) und die Rekonstruktion mit der „Clavicula pro humero“-Rekonstruktion; c) im Winter (4 Monate postoperativ) kam es zum Sturz und zur Fraktur/Verbiegung der Reko-Platte; d) nach konservativer Therapie 2 Jahre postoperativ Konsolidation und gute Funktion (Stabilität proximal – gute Funktion in Ellbogen und Unterarm)
Obwohl die Entscheidung für ein bewegliches oder festes Glenohumeralgelenk wesentlich vom Deltoideus abhängt, wird die Funktion beider Arten der Rekonstruktion durch die Wiederherstellung der aktiven Rotation (durch die glenohumeralen oder skapulothorakalen Artikulationen) bestimmt. Ein sinnvolles Ziel ist es, einen Rotationsbogen von etwa 90° von der Hand-zum-Bauch- bis zur neutralen Position (geradeaus) zu erreichen. Dies ermöglicht die meisten täglichen Aktivitäten, insbesondere in Kombination mit mindestens 30° Abduktion. Die Wiederbefestigung des Pectoralis major ermöglicht eine kompetente Innenrotation, und die Verlagerung von Teres major und/oder des Latissimus dorsi auf die posterosuperiore Seite des Humeruskopfes oder an eine allfällige Osteosyntheseplatte sorgt für eine ausreichende Außenrotation.27
In Fällen, in denen ein funktionierender Deltamuskel erhalten werden kann, kann eine mobile glenohumerale Rekonstruktion nützlich sein. Zu den traditionellen Optionen gehören ein osteoartikuläres Allotransplantat21,22 und rezyklierter autogener Knochen (extrakorporal bestrahlt oder pasteurisiert).28,29 Beide führen zu relativ hohen Revisionsraten aufgrund von Resorption, Frakturen und Infektionen.
Über endoprothetischen Ersatz wurde berichtet, mit variabler und manchmal unbefriedigender Funktion und sekundären Problemen wie Subluxation.21,28 Allograft (oder wiederaufbereiteter Knochen),30 Prothesenverbundstoffe (APC), Endoprothesen und osteoartikuläre Allografts führen zu einer ähnlichen Funktion. Allerdings weisen APCs eine geringere Fraktur- und Revisionsanfälligkeit auf.
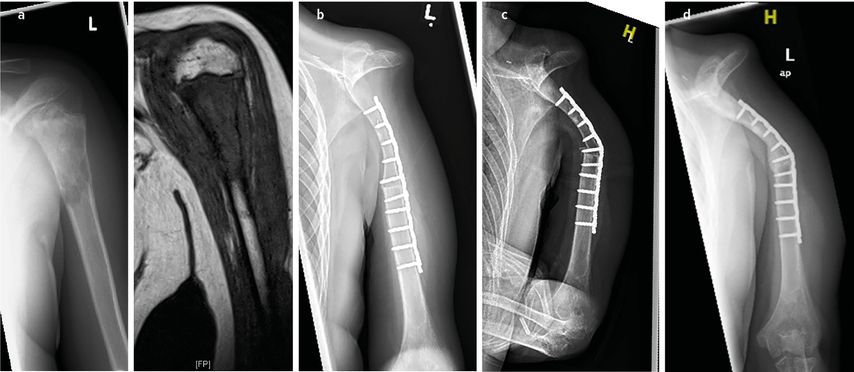
Im diaphysären Bereich des Humerus/Vorderarms oder bei erhaltener Epiphyse/ Metaphyse proximal bzw. distal haben sich biologische Rekonstruktionen mit vaskularisiertem oder nicht vaskularisiertem Autograft langfristig gerade bei Kindern und Jugendlichen bewährt.31 Das Remodellierungspotenzial – selbst nicht vaskularisierter Fibulae – ist in dieser Altersgruppe sehr gut. Gelenke können durch Zehengelenktransfers rekonstruiert werden (Abb. 4).
Abb. 4: 16-jähriger Junge mit einem Chondrosarkom des rechten Humerus; a) präoperatives anteroposteriores Röntgenbild; b) postoperatives Röntgenbild nach weiter Resektion (R0) und Implantation eines nicht vaskularisierten Fibulatransplantats. Die Fibula war nur in den proximalen und distalen Teilen des Humerus verkeilt; c) traumatische Querfraktur des Transplantats 6 Jahre nach der Rekonstruktion. Die konservative Behandlung bestand in einer Oberarmstütze; d) gute Kallusbildung nach 3 Monaten; e) 26,5 Jahre nach der Operation mit Integration und Umbau des Transplantats; f) vollständige Regeneration der Fibula
Bösartige Knochentumoren an der Hand und am Unterarm sind viel seltener in unserer Datenbank anzutreffen. Insbesondere an der Hand sollten bei der Rekonstruktion die Prinzipien des Basishandkonzeptes und der ästhetisch akzeptablen Hand berücksichtigt werden. Eine Greiffunktion ist, wann immer möglich, bei den jungen Patienten zu rekonstruieren. Bionische Prothesen werden immer besser und stellen in gewissen Fällen sicherlich eine valable Alternative bei erwachsenen Patienten dar; bei Kindern sind sie oft zu schwer/unhandlich und aufgrund der nicht ganz einfachen Steuerung und fehlenden Sensibilität der Rekonstruktion unterlegen.
Eine sogenannte Basishand besteht aus einem stabilen, kontrollierbaren sensiblen Daumen, einer weiten Griffspanne und einem stabilen, wenn möglich sensiblen Pfosten, gegen welchen dieser Daumen bewegt werden kann. Zusätzliche Elemente, wie eine Beweglichkeit des Pfostens oder ein zweiter Finger zum Erreichen eines Dreipunktegriffs, sind wünschenswert, stellen aber bereits funktionelle Verbesserungen dar. Paco del Pinal hat diese Rekonstruktionsziele 2006 in einem Übersichtsartikel genauer definiert.32 Techniken, die dafür zum Einsatz kommen, sind auch bei Kindern Zehentransfers, freie funktionelle Muskeltransfers, Sehnenumlagerungen und Nervenrekonstruktionen.
Kleinere Knochendefekte können auch mit einem freien mikrovaskulären Knochentransplantat, z.B. aus der Femurkondyle, oder avaskulär rekonstruiert werden.33
Haut-Weichteil-Defekte an der Hand und am distalen Unterarm sollten wann immer möglich primär rekonstruiert werden, um der Entwicklung von Granulationsgewebe zuvorzukommen, welches die vielen funktionell gleitenden Strukturen ummauert. Ist dies aus tumordiagnostischen Gründen nicht möglich, kann kurzzeitig ein Unterdruckverband für wenige Tage (<7 Tage) angelegt werden.34
Nervenrekonstruktionen können auch mit Allografts durchgeführt werden. Zum aktuellen Zeitpunkt ist die Studienlage hierzu aber noch sehr von der Herstellerfirma geprägt und eine Rekonstruktion mit Autografts noch zu bevorzugen.35
Für alle jungen Patienten gilt, dass die Vermeidung von zahlreichen Revisionen und eine Langlebigkeit in der Größenordnung mehrerer Jahrzehnte notwendig sind, um nicht zu sehr auf Endoprothesen angewiesen zu sein. Viele Chirurgen haben Pionierarbeit geleistet im Entwickeln biologischer Ansätze, die vielversprechende Alternativen darstellen. Die Kombination von biologischer Skelettrekonstruktion mit Sehnentransfers und Nerventransplantationen oder Transfers in Zusammenarbeit mit plastischen Chirurgen erfordert einen enormen Zeit- und Arbeitsaufwand, kann aber tiefgreifenden langfristigen Nutzen bringen.
Literatur:
1 Krieg A et al.: Impact of single center treatment on Ewing sarcoma 10-year long term survival rates. Acta Chir Orthop Traumatol Cech 2017; 84(6): 431-5 2 Hefti F: Tumoren an der oberen Extremität. In: Kinderorthopädie in der Praxis. Berlin Heidelberg: Springer, 2015. S. 604-10 3 Noordin S et al.: Unicameral bone cysts: current concepts. Ann Med Surg 2018; 34: 43-9 4 Choi JH, Ro JY: The 2020 WHO classification of tumors of bone: an updated review. Adv Anat Pathol 2021; 28(3): 119-38 5 Ong SLM et al.: Expanding the spectrum of EWSR1-NFATC2-rearranged benign tumors: a common genomic abnormality in vascular malformation/hemangioma and simple bone cyst. Am J Surg Pathol 2021; 45(12): 1669-81 6 Kaelin A, MacEwen G: Unicameral bone cysts. J International Orthopaedics 1989; 13(4): 275-82 7 Akita S et al.: Long-term results of surgery for forearm deformities in patients with multiple cartilaginous exostoses. J Bone Joint Surg Am 2007; 89(9): 1993-9 8 Litzelmann E et al.: Forearm deformities in hereditary multiple exostosis: clinical and functional results at maturity. J Pediatr Orthop 2012; 32(8): 835-41 9 Shapiro F et al.: Hereditary multiple exostoses. Anthropometrie, roentgenographic, and clinical aspects. J Bone Joint Surg Am 1979; 61(6A): 815-24 10 Noonan KJ et al.: Evaluation of the forearm in untreated adult subjects with multiple hereditary osteochondromatosis. J Bone Joint Surg Am 2002; 84(3): 397-403 11 Masada K et al.: Operations for forearm deformity caused by multiple osteochondromas. J Bone Joint Surg Br 1989; 71(1): 24-9 12 Jo AR et al.: An evaluation of forearm deformities in hereditary multiple exostoses: factors associated with radial head dislocation and comprehensive classification. J Hand Surg Am 2017; 42(4): 292.e1-292.e8 13 Farr et al.: Reliability of the Masada and Jo classifications for multiple hereditary exostoses in the forearm. J Hand Surg Eur 2021; 46(3): 318-20 14 Sin EK et al.: Treatment of multiple hereditary osteochondromas of the forearm in children. JBone Joint Surg Br 2006; 88(2): 255-60 15 Akita S et al.: Long-term results of surgery for forearm deformities in patients with multiple cartilaginous exostoses. J Bone Joint Surg Am 2007; 89(9): 1993-9 16 Roposch A et al.: Flexible intramedullary nailing for the treatment of unicameral bone cysts in long bones. J Bone Joint Surg Am 2000; 82(10): 1447-53 17 Zehetgruber H et al.: Prevalence of aneurysmal and solitary bone cysts in young patients. Clin Orthop Relat Res 2005; 439: 136-43 18 Dong C et al.: Percutaneous cyst aspiration with injection of two different bioresorbable bone cements in treatment of simple bone cyst. J Child Orthop 2020; 14(1): 76-84 19 Rapp TB et al.: Aneurysmal bone cyst. J Am Acad Orthop Surg 2012; 20(4): 233-41 20 Linberg BE: Interscapulo-thoracic resection for malignant tumors of the shoulder joint region. 1928. Clin Orthop Relat Res 1999; (358): 3-7 21 O’Connor MI et al.: Limb salvage for neoplasms of the shoulder girdle. Intermediate reconstructive and functional results. J Bone Joint Surg Am 1996; 78(12): 1872-88 22 Probyn LJ et al.: A comparison of outcome of osteoarticular allograft reconstruction and shoulder arthrodesis following resection of primary tumours of the proximal humerus. Sarcoma 1998; 2(3-4): 163-70 23 Mimata Y et al.: Glenohumeral arthrodesis for malignant tumor of the shoulder girdle. J Shoulder Elbow Surg 2015; 24(2): 174-8 24 Padiolleau G et al.: Scapulo-humeral arthrodesis using a pedicled scapular pillar graft following resection of the proximal humerus. Orthop Traumatol Surg Res 2014; 100(2): 177-81 25 Winkelmann WW: [Clavicula pro humero – a new surgical method for malignant tumors of the proximal humerus]. Z Orthop Ihre Grenzgeb 1992; 130(3): 197-201 26 Barbier D et al.: Is the clavicula pro humero technique of value for reconstruction after resection of the proximal humerus in children? Clin Orthop Relat Res 2017; 475(10): 2550-61 27 Hopyan S: Reconstruction for bone tumours of the shoulder and humerus in children and adolescents. J Child Orthop 2021; 15(4): 358-65 28 Liu T et al.: Treatment and outcome of malignant bone tumors of the proximal humerus: biological versus endoprosthetic reconstruction. BMC Musculoskelet Disord 2014; 15: 69 29 Takenaka S et al.: Clinical outcomes of osteoarticular extracorporeal irradiated autograft for malignant bone tumor. Sarcoma 2020; 2020: 9672093 30 Moran M, Stalley PD: Reconstruction of the proximal humerus with a composite of extracorporeally irradiated bone and endoprosthesis following excision of high grade primary bone sarcomas. Arch Orthop Trauma Surg 2009; 129(10): 1339-45 31 Lenze U et al.: Non-vascularised fibula grafts for reconstruction of segmental and hemicortical bone defects following meta- /diaphyseal tumour resection at the extremities. BMC Musculoskeletal Disorders 2017; 18(1): 289 32 del Piñal F: Severe mutilating injuries to the hand: guidelines for organizing the chaos. J Plast Reconstr Aesthet Surg 2007; 60(7): 816-27 33 Kaiser B et al.: [Bone reconstruction in the upper extremity other than the scaphoid with the free vascularized medial femoral condyle]. Handchir Mikrochir Plast Chir 2022; online ahead of print 34 McKinley TO et al.: Management of mangled extremities and orthopaedic war Injuries. J Orthop Trauma 2018; 32(Suppl 1): S37-42 35 Kaleem A et al.: Processed nerve allografts in reconstructive microneurosurgery after ablative head and neck surgery: an overview. Frontiers of Oral Maxillofacial Medicine 2020; 2: 16
Das könnte Sie auch interessieren:
«Auch Patienten mit Demenz profitieren von einer chirurgischen Stabilisierung»
Patienten mit Hüftfraktur und einer leichten, mittelschweren oder schweren Demenz haben ein geringeres Risiko zu sterben, wenn sie operiert werden – vor allem wenn es sich um Kopf-Hals- ...
Management periprothetischer Frakturen am Kniegelenk
Mit steigenden Versorgungszahlen der Knieendoprothetik und dem höheren Lebensalter entsprechend der Alterspyramide nimmt auch die Zahl der periprothetischen Frakturen zu und stellt die ...
Patellofemorale Instabilität
In diesem Übersichtsartikel möchten wir ein Update über die aktuelle Diagnostik und die konservativen wie auch operativen Behandlungsmöglichkeiten der patellofemoralen Instabilität geben.