<p class="article-intro">Das Grading des Urothelkarzinoms (UK) ist immer wieder ein Thema, das Pathologen und Urologen beschäftigt. Das Bestimmen eines Grades erlaubt die Differenzierung eines UK zu bewerten und spielt daher auch eine wichtige Rolle für die Behandlung des Patienten. Ein Grad wird prinzipiell nur den nicht in den Detrusormuskel einwachsenden Tumoren (NMIBC/„non muscle invasive bladder cancer“) gegeben. Zu dieser Gruppe gehören pTa-, pT1- und pTis(Carcinoma in situ)-Tumoren. Alle in den Detrusor einwachsenden UK werden automatisch als hochgradige Tumoren betrachtet (pT2–4).<sup>1</sup></p>
<hr />
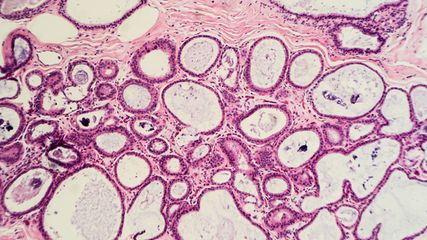
<p class="article-content"><h2>Grading der pTa-Tumoren</h2> <p>Bei den pTa-Tumoren, also den nicht in die Lamina propria einwachsenden Tumoren, ist der Grad sehr wichtig, da er über die Behandlung mit beispielsweise einer BCG-Therapie entscheidet. Die pT1-Tumoren können prinzipiell auch mit einem Grad bedacht werden, wir werden später darauf zurückkommen. Das Carcinoma in situ wird immer als hochgradige Läsion betrachtet, es ist unnötig, dies im Befund hinzuzufügen (Abb. 1). Im Falle einer Dysplasie wird die Läsion als niedriggradig und nicht zu behandelnd angesehen. Die Dysplasie ist eine problematische Läsion. Erstens ist die Definition relativ vage, zweitens ist die Intra- und Interobserver- Variabilität sehr hoch. Es gibt auch keine genau definierten Cut-offs, sollte eine immunhistochemische Untersuchung zum Einsatz kommen. Abgesehen davon, und das wird auch in der aktuellen WHO-Klassifikation 2016 deutlich festgehalten, hat die Immunhistochemie absolut keine Berechtigung bei dem Grading, das einzig und alleine auf der Tumormorphologie beruht.<sup>1</sup><br /> Die Evaluation des Grades beruht auf den zytologischen und architektonischen Ungleichheiten bei niedriger und mittlerer Vergrößerung (x 100 & x 200). Meist sind die Atypien aber schon bei schwächerer Vergrößerung zu sehen. Der Pathologe soll die zytologischen Veränderungen, also unterschiedliche Kerngrößen, Kernformen und Atypien des Chromatins, feststellen, aber auch die architektonischen Veränderungen bewerten, wie die unterschiedliche Zellorientierung zueinander und ihre Orientierung bezüglich der Basalmembran. All diese Kriterien, aber auch atypische Mitosen und Tumornekrosen spielen eine Rolle bei der Bewertung.</p>
<p class="article-intro">Das Grading des Urothelkarzinoms (UK) ist immer wieder ein Thema, das Pathologen und Urologen beschäftigt. Das Bestimmen eines Grades erlaubt die Differenzierung eines UK zu bewerten und spielt daher auch eine wichtige Rolle für die Behandlung des Patienten. Ein Grad wird prinzipiell nur den nicht in den Detrusormuskel einwachsenden Tumoren (NMIBC/„non muscle invasive bladder cancer“) gegeben. Zu dieser Gruppe gehören pTa-, pT1- und pTis(Carcinoma in situ)-Tumoren. Alle in den Detrusor einwachsenden UK werden automatisch als hochgradige Tumoren betrachtet (pT2–4).<sup>1</sup></p>
<hr />
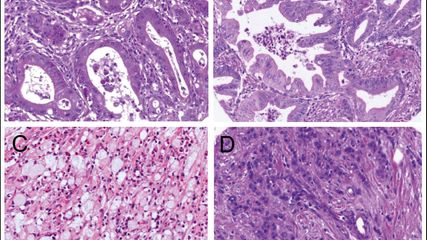
<p class="article-content"><h2>Grading der pTa-Tumoren</h2> <p>Bei den pTa-Tumoren, also den nicht in die Lamina propria einwachsenden Tumoren, ist der Grad sehr wichtig, da er über die Behandlung mit beispielsweise einer BCG-Therapie entscheidet. Die pT1-Tumoren können prinzipiell auch mit einem Grad bedacht werden, wir werden später darauf zurückkommen. Das Carcinoma in situ wird immer als hochgradige Läsion betrachtet, es ist unnötig, dies im Befund hinzuzufügen (Abb. 1). Im Falle einer Dysplasie wird die Läsion als niedriggradig und nicht zu behandelnd angesehen. Die Dysplasie ist eine problematische Läsion. Erstens ist die Definition relativ vage, zweitens ist die Intra- und Interobserver- Variabilität sehr hoch. Es gibt auch keine genau definierten Cut-offs, sollte eine immunhistochemische Untersuchung zum Einsatz kommen. Abgesehen davon, und das wird auch in der aktuellen WHO-Klassifikation 2016 deutlich festgehalten, hat die Immunhistochemie absolut keine Berechtigung bei dem Grading, das einzig und alleine auf der Tumormorphologie beruht.<sup>1</sup><br /> Die Evaluation des Grades beruht auf den zytologischen und architektonischen Ungleichheiten bei niedriger und mittlerer Vergrößerung (x 100 & x 200). Meist sind die Atypien aber schon bei schwächerer Vergrößerung zu sehen. Der Pathologe soll die zytologischen Veränderungen, also unterschiedliche Kerngrößen, Kernformen und Atypien des Chromatins, feststellen, aber auch die architektonischen Veränderungen bewerten, wie die unterschiedliche Zellorientierung zueinander und ihre Orientierung bezüglich der Basalmembran. All diese Kriterien, aber auch atypische Mitosen und Tumornekrosen spielen eine Rolle bei der Bewertung.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Urologik_Uro_1902_Weblinks_a5-abb1.jpg" alt="" width="575" height="497" /></p> <p><strong>„Low grade“- und „ High grade“- Urothelkarzinome</strong><br /> Seit 1998 gibt es ein neues Grading: Die UK sollen als „low grade“ (niedriggradig) oder „high grade“ (hochgradig) charakterisiert werden (Abb. 2 und 3). Diese Klassifizierung hat die von 1973 abgelöst, die G1, G2 und G3 beinhaltete.<sup>2, 3</sup> Das Hauptproblem der Klassifizierung nach WHO 1973 war v. a. die Gruppe der G2-Tumoren. Diese Gruppe war extrem heterogen, es gab G2-Tumoren, die beinahe G1-Tumoren waren, also sehr niedriggradig, es gab aber auch G2-Tumoren, die relativ hochgradig waren und auch in diese Gruppe fielen. Daher gab es oft das Dilemma in der Behandlung dieser G2-Tumoren. Die momentane Klassifizierung der WHO 2004/2016 hat im Gegensatz zu der von 1973 sehr präzise diagnostische Kriterien und ein weiterer Vorteil ist, dass Tumoren, die als niedriggradig eingestuft werden, dies auch wirklich sind.<sup>1</sup> Es ist richtig, dass wir seither etwas mehr hochgradige Tumoren diagnostizieren, doch trifft das eher auf eine Minderheit zu. Der Urologe hat mit der WHO-Klassifizierung 2016 auf jeden Fall einen Befund, der sich auf nachvollziehbare Kriterien stützt.<br /> Es gibt leider noch immer eine Gruppe „ewiggestriger“ Urologen und Pathologen, die der alten Klassifizierung von 1973 anhängen, diese ist jedoch wirklich obsolet. Es gab und gibt auch Versuche, ein 4-gradiges System einzuführen. Nun muss man anführen, dass solch ein System in den nächsten Jahren von pathologischer Seite, aber auch von der WHO sicher nicht angenommen werden wird, des Weiteren ist es ganz sicher nicht sinnvoll, aufgrund der (Intra- und Interobserver-)Variabilität ein 4-Grad-System einzuführen, denn die Konkordanz würde darunter leiden. Der Sinn einer Klassifikation ist ja, dass sie leicht anzuwenden und für jedermann verständlich und dadurch eine gute Konkordanz gegeben ist. Beides stimmt für die seit 1998 existierende Klassifizierung, die 2004 von der WHO aufgenommen wurde. Der vor Kurzem erschienene Artikel von May und Soukup konnte zeigen, dass mit der WHO-2004/2016-Klassifikation eine geringere Intra- und Interobserver-Variabilität erzielt werden kann.<sup>4, 5</sup></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Urologik_Uro_1902_Weblinks_a5-abb2.jpg" alt="" width="573" height="489" /></p> <p><strong>Heterogene Urothelkarzinome</strong><br /> Ein weiteres Problem sind die heterogenen Tumoren. Je nach Studie existieren diese Tumoren in 3–43 % der Fälle. Sowohl die ISUP (International Society of Uropathology) als auch die ICCR (International Collaboration of Cancer Reporting) haben vorgeschlagen, diese gemischten Tumoren als hochgradig einzustufen. Die WHO-2004-Klassifikation schlug ebenfalls dieses Prozedere vor.<sup>1, 6</sup> Bisher gab es sehr wenig Literatur zum Thema. In einem Paper von Chen et al. aus dem Jahr 2000 wird vorgeschlagen, Tumoren mit einem „High grade“(HG)-Kontingent bis zu 5 % weiterhin als „low grade“ (LG) einzustufen.<sup>7</sup> Einige neuere Papers schienen dies vom klinischen Standpunkt her zu bestätigen. Gofrit et al. konnten zeigen, dass Tumoren mit einem HG-Kontingent bis zu 10 % sich eher wie LG-Tumoren verhielten.<sup>8</sup> Ein relativ neues Paper von Downes et al. untersuchte, leider mit einer kleinen Fallzahl, heterogene Tumoren auf morphologischer, proteomischer und molekularer Ebene.<sup>9</sup> Die Autoren konnten zeigen, dass in heterogenen Tumoren bereits in den LG-Zonen Veränderungen auf molekularer, aber auch auf Proteinebene vorkommen, die denen in den HG-Zonen gleichen. Diese Studie konnte bestätigen, dass die Veränderungen offensichtlich bereits in morphologischen, noch nach LGTumoren aussehenden Zonen vorhanden sind. Dies unterstützt die Vision der oben angeführten Organisationen, dass diese heterogenen Tumoren eindeutig als hochgradig einzustufen sind. Das ICCR schlägt in seinen standardisierten Befunden vor, Prozentangaben zu machen. Dieses Vorgehen ist insofern sinnvoll, als es damit dem Urologen überlassen bleibt, wie er, der den Patienten ja vor Augen hat und den Tumor makroskopisch gesehen hat, weiter vorgehen will.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Urologik_Uro_1902_Weblinks_a5-abb3.jpg" alt="" width="573" height="489" /></p> <h2>Grading der pT1-Tumoren</h2> <p>Das Grading der pT1-Tumoren ist ebenfalls ein Thema, bei dem eine gewisse Uneinigkeit besteht. In der WHO-2016-Klassifikation gibt es nach wie vor die Möglichkeit, in die Lamina propria einwachsende UK als LG einzustufen. Dies ist eher selten der Fall, denn die meisten pT1-Tumoren sind hochgradige Läsionen, mit der Gefahr, dass sie, sobald sie in die Lamina propria einwachsen, Tumoremboli formen und Metastasen streuen. Die WHO-2016-Klassifikation empfiehlt, auch wenn sie sich nicht über die Methode auslässt, ein Substaging der pT1-UK, denn dieses ist aussagekräftiger als der Grad. Die ICCR empfiehlt, entweder die Ausbreitung und die Tiefe der Infiltration zu messen oder die pT1-Tumoren in pT1a/b zu unterteilen. pT1a-Tumoren wachsen nicht weiter als bis zur Lamina muscularis mucosae ein, pT1b-Tumoren können bis zum Detrusor in die Blasenwand einwachsen, ohne diesen zu infiltrieren. Es ist auch wichtig zu unterstreichen, dass das UK, solange es nur in Kontakt mit dem Muskel ist, ohne ihn zu infiltrieren, nach wie vor als pT1-Tumor zu diagnostizieren ist.</p> <p><strong>Histologische Varianten</strong><br /> Ein wichtiger Punkt im Grading der pT1-Tumoren ist auch die Präsenz der histologischen Varianten. Es ist mit ziemlicher Sicherheit unsinnig, Varianten wie dem „nested carcinoma“ oder dem „large nested carcinoma“ einen Grad zu geben.<sup>6</sup> Wir wissen, dass diese Urothelkarzinome ein aggressives, in den Muskel einwachsendes Verhalten entwickeln können, und dies, obwohl sie vom zytologischen Standpunkt her wenig oder gar keine Atypien zeigen. Eines der aktuellen Probleme mit den retrospektiven Studien, die sich mit dem Grading beschäftigen, ist, dass Fälle, die vor dem Erscheinen der aktuellen WHO-2004/2016- Klassifikation diagnostiziert wurden, ohne zentralen Review einfach in diese Studien miteinbezogen werden. Daher kann es durchaus zu Studienergebnissen kommen, die nicht der Realität der Blasenkarzinome entsprechen; mit hohen Zahlen von pT1- LG-Tumoren oder, noch schlimmer, pT1-G1-Tumoren, sofern der Pathologe nach wie vor das System von 1973 verwendet hat. Diese Praktiken sind gefährlich, denn sie wiegen Patienten und Urologen in falscher Sicherheit.</p> <h2>„Inverted lesions“</h2> <p>Zum Schluss noch zu einem wenig beachteten Problem, dem der „inverted lesions“, also Tumoren mit endophytischem Wachstum. Diese Tumoren stellen den Pathologen vor mehrere Probleme: Zuerst die Frage, ob der Tumor tangential angeschnitten ist und es sich in Wahrheit vielmehr um eine exophytische Läsion handelt – oder handelt es sich um einen endophytischen nicht infiltrierenden Tumor, oder wächst die Läsion doch in die Lamina propria ein? Diese Tumoren haben oft „pushing borders“, also Tumorlimits, die das darunterliegende Gewebe verdrängen und es extrem schwierig gestalten, eine Infiltration zu diagnostizieren. Der Pathologe steht oft vor der Frage, ob der Tumor wirklich in die Lamina propria einwächst oder einfach nur, ohne zu infiltrieren, das Gewebe verdrängt. Sollte man ein endophytisches Wachstum vermuten, dann muss der Pathologe auch hier einen Grad attribuieren, auch hier ist in dem Befund ein LG oder HG zu erwähnen.</p> <h2>Fazit</h2> <p>Alles in allem gibt es im Grading des Urothelkarzinoms leider noch gewisse Unstimmigkeiten, v. a. zwischen Pathologen und den europäischen Urologen, die nach wie vor teilweise an der WHO-1973-Klassifikation festhalten. Dieses Problem stellt sich beispielsweise absolut nicht in den USA. Abgesehen davon, dass das System der WHO-1973-Klassifikation obsolet ist und viele Unklarheiten besonders in Bezug auf G2 bestehen, möchte ich auch unterstreichen, dass dieses System eine höhere Intra- und Interobserver-Variabilität hat und aus diesen und vielen anderen Gründen das WHO-2004/2016-System zu bevorzugen ist.<sup>1, 6</sup></p></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Moch H et al.: WHO Classification of Tumours, Volume 8. IARC WHO Classification of Tumours, No 8. (IARC) <strong>2</strong> Epstein JI et al.: The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Bladder Consensus Conference Committee. Am J Surg Pathol 1998; 22(12): 1435-48 <strong>3</strong> Mostofi FK: International histologic classification of tumors. A report by the Executive Committee of the International Council of Societies of Pathology. Cancer 1974; 33(5): 1480-4 <strong>4</strong> May M et al.: Prognostic accuracy of individual uropathologists in noninvasive urinary bladder carcinoma: a multicentre study comparing the 1973 and 2004 World Health Organisation classifications. Eur Urol 2010; 57(5): 850-8 <strong>5</strong> Soukup V et al.: Prognostic performance and reproducibility of the 1973 and 2004/2016 World Health Organization Grading Classification Systems in non-muscle- invasive bladder cancer: a European Association of Urology Non-muscle Invasive Bladder Cancer Guidelines panel systematic review. Eur Urol 2017; 72(5): 801-13 <strong>6</strong> ICCR-Urinary-Tract-Bladder-bookmarked-guide.pdf <strong>7</strong> Cheng L et al.: Grading and staging of bladder carcinoma in transurethral resection specimens. Correlation with 105 matched cystectomy specimens. Am J Clin Pathol 2000; 113(2): 275-9 <strong>8</strong> Gofrit ON et al.: Mixed high and low grade bladder tumors – are they clinically high or low grade? J Urol 2014; 191(6): 1693-6 <strong>9</strong> Downes MR et al.: Analysis of papillary urothelial carcinomas of the bladder with grade heterogeneity: supportive evidence for an early role of CDKN2A deletions in the FGFR3 pathway. Histopathology 2017; 70(2): 281-9</p>
</div>
</p>