Die Pathologie des Magenkarzinoms
Autor:
Prof. Dr. Rupert Langer
Kepler Universitätsklinikum und
Johannes Kepler Universität Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Weltweit ist das Magenkarzinom der am fünfthäufigsten diagnostizierte maligne Tumor, mit einer verhältnismäßig hohen Sterblichkeit, bedingt vor allem durch das weit fortgeschrittene Tumorstadium zum Zeitpunkt der Diagnose. Histologisch und molekulargenetisch lassen sich verschiedene Subtypen des Magenkarzinoms abgrenzen, welche im Folgenden näher erläutert werden.
Epidemiologie und Risikofaktoren
Das Magenkarzinom ist weltweit der am fünfthäufigsten diagnostizierte maligne Tumor, mit jährlich über 1 Million Neuerkrankungen und mit einer verhältnismäßig hohen Sterblichkeit, aufgrund des bei Diagnosestellung häufig fortgeschrittenen Tumorstadiums.1 Die Mehrzahl der Magenkarzinome ist sporadisch und auf eine Helicobacter-pylori-Infektion mit konsekutiver langjähriger Schädigung der Magenschleimhaut zurückzuführen.
Daneben spielen auch andere umweltbedingte Ursachen, wie höheres Alter, niedriger sozioökonomischer Status, Zigarettenrauchen, Alkoholkonsum, frühere Magenoperationen oder eine perniziöse Anämie, ätiologisch eine Rolle.2 10% der Magenkarzinome haben einen familiären Hintergrund, davon sind wiederum bis zu ein Drittel hereditär mit autosomal dominantem Vererbungsmuster (z.B. hereditäres Magenkarzinom vom diffusen Typ, Lynch-Syndrom oder Magenkarzinom mit proximaler Polyposis des Magens, Peutz-Jeghers-Syndrom etc.).3 Das proximale Magenkarzinom (Kardiakarzinom/Adenokarzinom des gastroösophagealen Übergangs Typ III) hingegen hat eine andere Pathogenese und wie das Ösophagusadenokarzinom eher die gastro-ösophageale Refluxerkrankung als Risikofaktor.
Morphologie und Molekulargenetik
Histologisch und molekulargenetisch lassen sich verschiedene Subtypen des Magenkarzinoms abgrenzen. Zwischen Histologie und Molekulargenetik besteht ein signifikanter Zusammenhang, ebenso wie die Makroskopie durch die Histologie bzw. letzlich auch die Molekulargenetik bestimmt wird.4
Makroskopie
Makroskopisch wachsen Magenkarzinome polypös-exophytisch, ulzerierend scharf begrenzt oder ulzerierend mit unscharfer Abgrenzung bis hin zu einer diffusen Ausbreitung, die mitunter den ganzen Magen einnimmt. Diese Wachstumsformen bilden die Grundlage von verschiedenen Klassifikationssystemen wie z.B. der Paris-Klassifikation für frühe Tumorstadien und der Borrmann-Klassifikation für fortgeschrittene Karzinome.
Bei der Paris-Klassifikation werden drei Typen unterschieden: protrudiert (Typ I), oberflächlich (Typ II, weiter unterteilt in erhaben, flach oder depressiv) oder exkaviert (Typ III); bei der Borrmann-Klassifikation vier Typen: polypoid breitbasig ohne Ulzeration (Typ I), ulzeriert mit aufgeworfenem Randwall (Typ II), ulzeriert mit diffuser breitbasiger Infiltration (Typ III) und diffus infiltrierender Wandverdickung (Typ IV). Der Borrmann-Typ korreliert auch mit dem histologischen Typ (s.u.), wobei die Borrmann-Typen I und II eher bei interstinalen Typen nach der Laurén-Klassifikation (bzw. tubulären oder papillären Karzinomen nach der WHO[„World Health Organisation“]-Klassifikation) beobachtet werden, und die Typen III und IV eher bei den diffusen bzw. „poorly cohesive“ Typen.
Histologie
Histologisch ist das Magenkarzinom durch eine große morphologische Vielfalt gekennzeichnet, was in der Vergangenheit eine Reihe von Klassifikationssystemen hervorgebracht hat. In der westlichen Welt sind die Laurén-Klassifikation5 und die WHO-Klassifikation6 die am häufigsten verwendeten Systeme.
Die Laurén-Klassifikation unterscheidet je nach histologischem Wachstumsmuster zwischen einem intestinalen Typ, einem diffusen Typ, einem gemischten Typ und einem nicht klassifizierbaren Typ. Seit der ursprünglichen Veröffentlichung im Jahr 1965 wurde jedoch eine große weitere Anzahl von histologisch distinkten Typen von Magenkarzinomen beschrieben, die sich mittels der Laurén-Klassifikation nicht zuordnen lassen. Trotz unterschiedlicher Tumorbiologie müssten diese somit einer einzigen – der unklassifizierbaren – Gruppe zugeteilt werden.
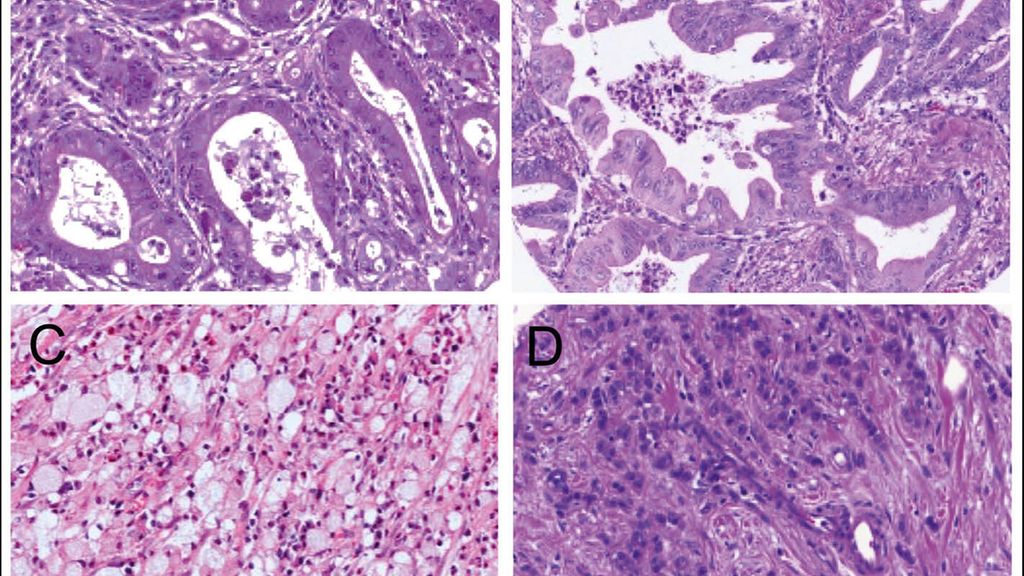
Die WHO-Klassifikation des Adenokarzinoms des Magens beschreibt folgende Typen: tubulär (inkl. solider wachsender Tumoren als schlecht differenzierte tubuläre Karzinome gewertet), papillär, muzinös, wenig kohäsiv („poorly cohesive“; inkl. Siegelringzell-haltiger Karzinome), gemischt (Abb. 1). Andere seltene Typen sind: Adenokarzinome mit lymphoidem Stroma, hepatoide Adenokarzinome, mikropapilläre Adenokarzinome, Adenokarzinome vom Fundusdrüsen-Typ und weitere noch seltenere Typen (mukoepidermoides Karzinom, Paneth-Zell-Karzinom, Parietalzellkarzinom). Plattenepithelkarzinome und adenosquamöse Karzinome sind ebenfalls selten.
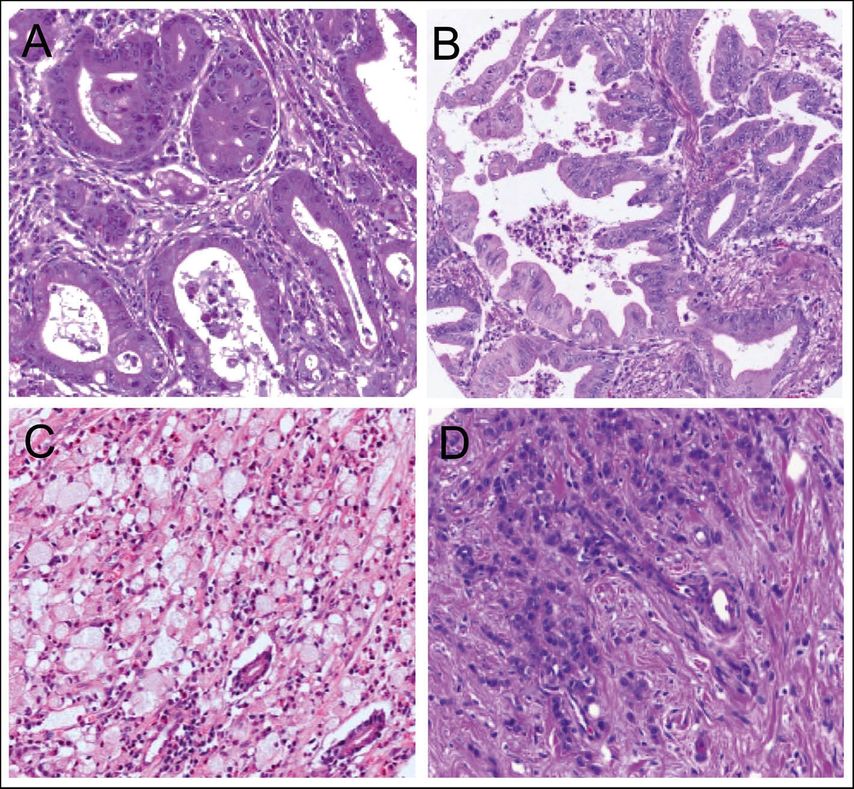
Abb. 1: Histologie von Magenkarzinomen. A, B: intestinaler Typ nach Laurén (A tubulär, B tubulo-papillär nach WHO). C, D: diffuser Typ nach Laurén, wenig kohäsiver Typ („poorly cohesive”) nach WHO (C mit Siegelringzellen, D ohne Siegelringzellen), jeweils Hämatoxylin-Eosin-Färbung
In der aktuellen Ausgabe der WHO-Klassifikation werden diese Subtypen der Laurén-Klassifikation gegenübergestellt, mit einer großen Überlappung zwischen dem intestinalen Typ und dem tubulären und papillären Subtyp auf der einen Seite und dem diffusen Typ sowie dem wenig kohäsiven Subtyp auf der anderen Seite. Es gelang zudem, diese Typen entsprechenden Pendants der in Asien verbreiteten Klassifikation der Japanese Gastric Cancer Association gegenüberzustellen.6 Neuroendokrine Tumoren sind in dieser Einteilung nicht mitberücksichtigt. Obgleich die WHO-Klassifikation nun eine deutlich bessere Zuordnung der einzelnen histologischen Typen erlaubt, ist die große Zahl der verschiedenen Subtypen (speziell der selteneren Typen) für die Anwendung nicht sehr praktisch, sodass sich die Subtypisierung nach der WHO-Klassifikation erst noch etablieren muss – nach wie vor wird die Laurén-Klassifikation sowohl im klinischen Alltag, bei offiziellen Statistiken (z.B. im Rahmen von Akkreditierungen) als auch in klinischen Studien verwendet. Zudem ist der histologische Subtyp, gleich welcher Klassifikationssystematik, derzeit auch nicht die alleinige Grundlage für Therapieentscheidungen im Rahmen einer individualiserten Tumorbehandlung.
Staging
Die histologische Stadieneinteilung wird nach der TNM-Klassifikation vorgenommen,7 wobei das Tumorstadium durch die Tiefeninvasion bestimmt wird. Bei den Frühkarzinomen gibt es für pT1a(Mucosa)-Karzinome und pT1b(Submucosa)-Karzinome noch weitere Subklassifikationen (m1–3 bzw. sm1–3 oder besser die metrische Angabe der Tiefeninfiltration), die vor allem für die Risikoabschätzung bezüglich einer Lymphknotenmetastasierung nach einer endoskopischen Resektion Relevanz haben. Die pN-Kategorie richtet sich nach der Anzahl der befallenen Lymphknoten.
Eine neoadjuvante Therapie kann deutliche Auswirkungen auf das Erscheinungsbild eines Magenkarzioms haben. Das Ansprechen des Tumors, das von einer kompletten Regression bis hin zu kaum sichtbaren Zeichen einer Regression reichen kann, kann durch die Anwendung eines Tumorregressionsgrades (TRG) kategorisiert werden.8 Es existieren einige TRG-Systeme, wobei es derzeit kein allgemein verbindlich empfohlenes TRG-System gibt. Vielmehr bestehen starke regionale Unterschiede bei der Verwendung dieser Systeme: Im deutschsprachigen Raum ist z.B. die Becker-Klassifikation sehr verbreitet, im restlichen Europa die Mandard-Klassifikation und weltweit (mit Ausnahme von Japan) die Ryan-Klassifikation, die auch vom „American Joint Committee on Cancer“ (AJCC) vorgeschlagen wird.9 Alle Systeme sind gut reproduzierbar und unterscheiden sich nur gering, und wenn, dann bezüglich der Bezugsgröße für die Bestimmung der Regression (z.B. Becker-System: Angabe von Prozent des Residualtumors; Mandard und Ryan/AJCC: beschreibende Kategorien).
Molekulare Klassifikationssysteme
Im Jahr 2014 wurden die Ergebnisse der Arbeit des Forschungsnetzwerks „The Cancer Genome Atlas“ (TCGA) am Magenkarzinom publiziert.10 Es handelte sich um die bis dahin umfassendsten genomweiten Analysen an Magenkarzinomen unter Einbeziehung der Analysen von DNA-Kopienzahlen, Mutationen und mRNA-, micro-RNA- und Proteinmustern.
Es gelang hierbei, vier molekular unterschiedliche Subtypen von Magenkarzinomen zu unterscheiden: Epstein-Barr-Virus-assoziiert (EBV+), Mikrosatelliten-instabil (MSI), genomisch stabil (GS) und chromosomal instabil (CIN). Ähnliche Ergebnisse zeigte eine Arbeit aus Hongkong, in der Whole-Genome Sequencing sowie ebenfalls DNA-Kopienzahl-Analysen neben Genexpressions- und Methylierungs-Profiling für eine integrative Genomanalyse verwendet wurden.11 Durch diese Arbeiten wurde bestätigt, dass die eher seltenen MSI- und EBV+-Magenkarzinome eigenständige molekulare Entitäten darstellen. Diese waren als solche bereits länger bekannt, es wurde jedoch noch nicht in dieser molekularen Detailliertheit und in Abgrenzung zu den anderen – insgesamt häufigeren – Subtypen aufgearbeitet.
Eine weitere Arbeit basierend auf mRNA-Expressionsprofilen wurde von der „Asian Cancer Research Group“ (ACRG) publiziert, die hier als distinkte Gruppen MSI-Karzinome, mikrosatellitenstabile (MSS) Karzinome mit epithelialer/mesenchymaler Transition (EMT), MSS Karzinome mit intaktem TP53 oder MSS mit TP53-Verlust klassifizieren konnte.12 Interessantwerweise konnten die EBV+-Karzinome hier nicht separiert werden, sondern wurden den Gruppen der MSS Non-EMT-Karzinome zugeordnet.
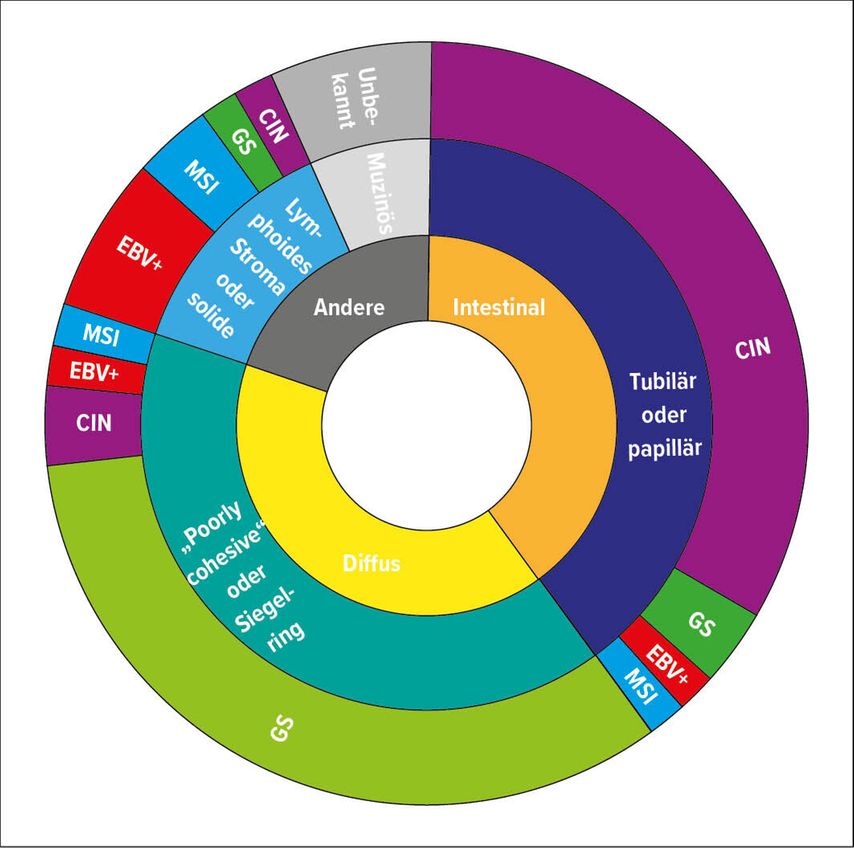
Gesamthaft jedoch überschneiden sich die in den verschiedenen Studien vorgeschlagenen molekularen Klassifikationen deutlich, sowohl untereinander als auch bezüglich der morphologischen Subtypen: insbesondere lassen sich die CIN(„chromosomal instable“)-Karzinome nach der TCGA-Klassifikation einem intestinalen Phänotyp zuordnen, die GS-Karzinome eher dem diffusen Typ bzw. den entsprechenden WHO-Typen (Abb. 2).4
Abb. 2: Schematischer Überblick über histologische und molekulare Subtypen des Magenkarzinoms. Modifiziert nach Smyth EC et al.4
Biomarker
Trotz des erheblichen Zuwachses an Wissen über den molekularen Hintergrund des Magenkarzinoms und seiner Subtypen konnte eine sichere prognostische oder prädiktive Relevanz bislang nicht gezeigt werden, obgleich EBV+-Karzinome in älteren Arbeiten generell eine günstigere Tumorbiologie zeigten.13 Diese Daten bezogen sich allerdings oftmals auf primär resezierte Tumoren, während mitterweile durch die multimodale Behandlung auch das Ansprechen auf die Therapie prognostisch relevant ist. Obwohl es scheint, dass bestimmte Subtypen mit unterschiedlichem Ansprechverhalten korrelieren könnten, sind sichere und bestätigte Daten bislang nicht verfügbar. Eine umfassende molekulargenetische Aufarbeitung, wie sie z.B. für das nicht kleinzellige Lungenkarzinom mittlerweile diagnostischer Standard ist, wird beim Magenkarzinom somit derzeit für eine therapeutische Entscheidungsfindung nicht benötigt.
Bezüglich routinemäßig verwendeter Biomarker ist derzeit lediglich die Bestimmung von HER2-neu („human epidermal growth factor receptor 2“) als prädiktiv für die entsprechende Antikörpertherapie relevant. Der HER2-Status wird mittels Immunhistochemie und bei nicht eindeutigen Befunden zusätzlicher In-situ-Hybridisierung für das HER2-Gen bestimmt.14 Für die Identifizierung von potenziellen Kandidaten für eine Immuntherapie kann der Mirkosatelliten-Status bzw. eine Mismatch-Reparatur-Defizienz bestimmt werden, daneben ist auch die Untersuchung des PD-L1(„programmed cell death ligand 1“)-Status mittels Immunhistochemie vielversprechend. Hier scheint bezüglich der Prädiktion des Ansprechens auf die Immuntherapie die Expression sowohl in den Tumorzellen als auch in den Immunzellen relevant zu sein. Der PD-L1-Status sollte deshalb mittels des „Combined Positivity Score“ (CPS), der beide Komponenten umfasst, angegeben werden.15 Andere aktuell vielversprechende Zielmoleküle für eine zielgerichtete Therapie, wie z.B. Claudin-18.2, wo auch das Expressionslevel als potenziell prädiktiv angesehen wird, werden derzeit noch untersucht und sind noch nicht als relevante Biomarker etabliert.4
Methoden
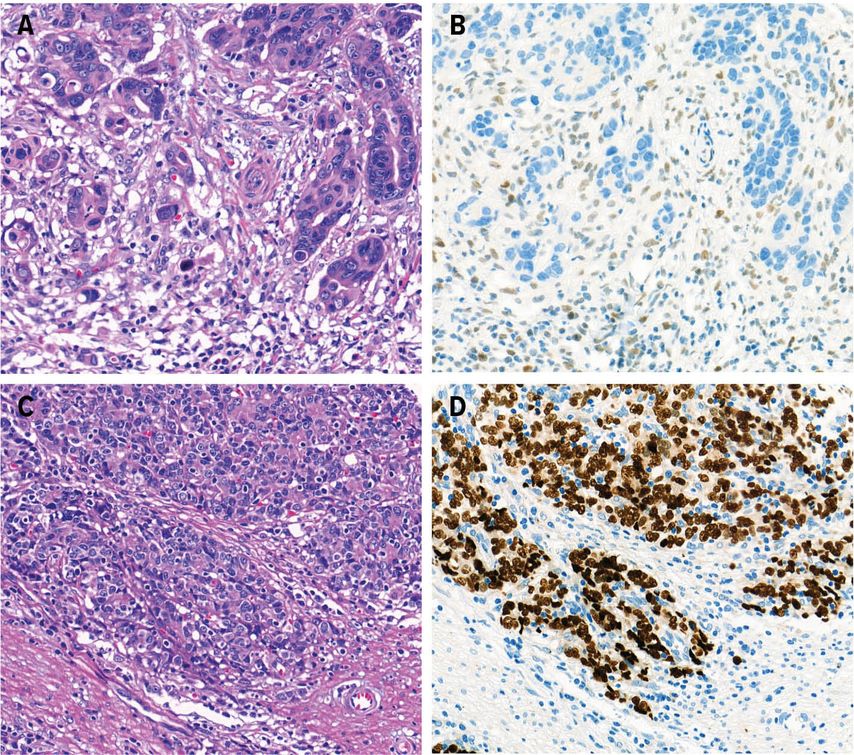
Goldstandard der Histopathologie ist die Hämatoxylin-Eosin(HE)-Färbung. Zusätzliche Spezialfärbungen für die Darstellung von Muzin können bei der Identifizierung von Siegelringzellen hilfreich sein, ebenso immunhistochemische Färbungen für z.B. eine bessere Bestimmung der Wuchsform. Die molekulare Klassifikation nach TCGA kann mittels Immunhistochemie (Expression der Mismatch-Repair-Proteine, TP53) und In-situ-Hybrisierung („Epstein–Barr virus-encoded small RNA“[EBER]/EBV) in sehr guter Annäherung relativ kostengünstig abgebildet werden (Abb 3).16
Abb. 3: Beispiele eines Mismatch-Reparatur-defizienten Magenkarzinoms (A und B) und eines EBV+-Magenkarzinoms (C und D). A: Hämatoxylin-Eosin-Färbung. B: Immunhistochemie für MutL-Homolog 1 (MLH-1; Ausfall der Expression). C: Hämatoxylin-Eosin-Färbung. D: EBV-in-situ-Hybridisierung (EBER). Während das EBV+-Karzinom eine deutliche lymphozytäre Begleitreaktion zeigt und als Magenkarzinom mit lymphoidem Stroma zu klassifizieren wäre, entspricht die Morphologie des hier gezeigten Mismatch-Reparatur-defizienten Karzinoms eher einem konventionellen intestinalen Typ nach Laurén. Dieses Beispiel zeigt, dass die molekulare Grundlage oft, jedoch nicht immer mit einer entsprechend typischen Morphologie einhergeht
Kürzlich wurde gezeigt, dass Machine-Learning in der Lage ist, die Molekulargenetik, insbesondere die MSI von gastrointestinalen Tumoren, ausgehend von HE-gefärbten Schnitten mit relativ hoher Sensitivität und Spezifität zu erkennen.17 Derartige neue digitale Techniken, kombiniert mit Morphologie, Immunphänotypisierung und Molekulargenetik, werden nicht nur neue Erkenntnisse bezüglich Tumorerkrankungen allgemein liefern, sondern auch eine potenziell schnellere, exaktere und kostengünstigere Diagnostik ermöglichen, inkl. der Prädiktion hinsichtlich verschiedener Arten von Therapien. Aufgrund der kürzlich vorgestellten Arbeiten ist davon auszugehen, dass dies auch auf das Magenkarzinom zutreffen wird.
Literatur:
1 Bray F et al.: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68(6): 394-424 2 Machlowska J et al.: Gastric cancer: Epidemiology, risk factors, classification, genomic characteristics and treatment strategies. Int J Mol Sci 2020; 21(11): 4012 3 van der Post et al.: Hereditary gastric cancer: what’s new? Update 2013–2018. Fam Cancer 2019; 18(3): 363-7 4 Smyth EC et al.: Gastric cancer. Lancet 2020; 396(10251): 635-48 5 Lauren P: The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. Acta Pathol Microbiol Scand 1965; 64: 31-49 6 WHO Classification of Tumours: Digestive system tumours. International Agency for Research on Cancer 2019: Lyon (France). 5th edition, volume 1 7 Brierley JD et al.: TNM classification of malignant tumours. Union Int Cancer Control 2017. 8th edition 8 Langer R, Becker K: Tumor regression grading of gastrointestinal cancers after neoadjuvant therapy. Virchows Arch 2018; 472(2): 175-86 9 AJCC: AJCC Cancer Staging Manual. AJCC Cancer Staging Manual. Springer International Publishing 2017. 8th edition 10 Cancer Genome Atlas Research Network: Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014; 513(7517): 202-9 11 Wang K et al.: Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer. Nat Genet 2014; 46(6): 573-82 12 Cristescu R et al.: Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015; 21(5): 449-56 13 van Beek J et al.: EBV-positive gastric adenocarcinomas: a distinct clinicopathologic entity with a low frequency of lymph node involvement. J Clin Oncol 2004; 22(4): 664-70 14 Rüschoff J et al.: HER2 testing in gastric cancer: a practical approach. Mod Pathol 2012; 25(5): 637 15 Shitara K et al.: Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: the keyno-te-062 phase 3 randomized clinical trial. JAMA Oncol 2020; 6(10): 1571-80 16 Koh J et al.: Development and validation of an easy-to-implement, practical algorithm for the identification of molecular subtypes of gastric cancer: prognostic and therapeutic implications. Oncologist 2019; 24(12): e1321-30 17 Kather JN et al.: Deep learning can predict microsatellite instability directly from histology in gastrointestinal cancer. Nat Med 2019; 25(7): 1054-6
Das könnte Sie auch interessieren:
Stellenwert der Zytologie und Histologie in der Pathologie des Harntraktes
Zytologie und Histologie kommen in der Abklärung des Harntraktes bei unterschiedlichen Fragestellungen und Konstellationen zum Einsatz. Die Kenntnis der zugrundeliegenden pathologischen ...
Das Grading des Urothelkarzinoms
Das Grading des Urothelkarzinoms (UK) ist immer wieder ein Thema, das Pathologen und Urologen beschäftigt. Das Bestimmen eines Grades erlaubt die Differenzierung eines UK zu bewerten und ...
The impact of inherited mutations in oncohaematology
Acquired mutations detection by the use of next-generation sequencing (NGS) is largely used in oncohaematology. Germline mutations have also shown to play a major role in this context ...