Ästhetische und funktionelle Rekonstruktion bei Gesichtslähmung
Autor:
Prof. Dr. Andreas Kehrer, FEBOPRAS, MHBA
Institut für Gesichtsrekonstruktionen bei Fazialisparese
IN-Aesthetik
Ingolstadt, Deutschland
E-Mail: info@faszialis.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Fazialisparesen stellen eine schwerwiegende funktionelle und ästhetische Beeinträchtigung dar, die sowohl das Selbstwertgefühl als auch die soziale Interaktion der Betroffenen erheblich beeinflusst. Innovative plastisch-chirurgische Verfahren wie Nerventransfers, motorische Ersatzplastiken und freie Muskeltransplantationen bieten vielversprechende Optionen, insbesondere bei frühzeitiger Behandlung.
Fazialisnerv und mimische Muskultur – Anatomie, Physiologie, Pathophysiologie
Der Fazialisnerv (lateinisch: Nervus facialis) entstammt dem zweiten Kiemenbogen und ist der siebte von zwölf Hirnnerven. Er hat speziell viszeroafferente und allgemein viszeroefferente (parasympathische) Faserqualitäten. Die gesamte mimische Muskulatur, 21 grösstenteils paarig angelegte Muskeln, sowie das Platysma, die Muskeln des äusseren Ohres, die Mm. stapedius und stylohyoideus und der Venter posterior des M. digastricus werden durch ihn innerviert. Freilinger et al. teilten die Gesichtsmuskulatur in vier Schichten ein, von denen die drei oberflächlicheren aus der Tiefe und die profund gelegene Muskelschicht (M. mentalis, M. levator anguli oris und M. buccinator) von der Oberfläche innerviert werden.1 Gesichtsmuskeln liegen ohne Faszien und mehrheitlich ohne Sehnen in der Subkutis.
Die Anzahl der motorischen Endplatten ist im Gegensatz zur Skelettmuskulatur auf bis zu vier pro Muskelzelle erhöht, wobei sie über den Faserverlauf unterschiedlich verteilt sind.2 Insertion und Hauptvektorrichtung der Muskeln variieren besonders im Bereich der Mund-/Wangenregion stark.3 Entsprechend ist die Mimik jedes Individuums ebenso individuell.
Extratemporale Äste werden in Rr. temporales, zygomatici, buccales, marginales mandibulae und R. colli unterteilt. Am anterioren Rand der Parotis sind bereits 14 Verästelungen beschrieben.4
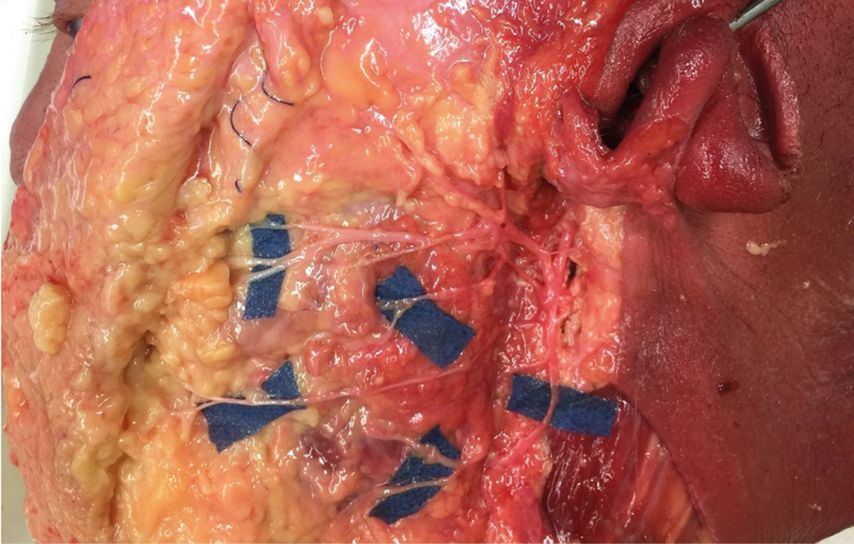
Kehrer et al. beschrieben in einer mikro- und makroanatomischen Fazialisnervenstudie an 106 Gesichtshälften frischer anatomischer Humanpräparate die Heterogenität der Astsysteme und auch die axonale Kapazität einzelner Haupt- und Unteräste (Abb. 1). Des Weiteren wurde eine neue klinisch orientierte anatomische Definition zur Differenzierung zygomatischer von buccalen Ästen im zygomaticobuccalen Plexus etabliert.5
Abb. 1: Fazialisstudie Universität Regensburg – anatomische Präparation einer Variante. Aufgrund der Heterogenität in Verlauf und Innervation sind fundierte makro- und mikroskopische Kenntnisse für Operationen am Gesichtsnerv unerlässlich77
Bezüglich der Pathologie sind analog zu anderen peripheren Nerven bei Läsionen des N. facialis die Formen Neurapraxie (Nerv z.B. gequetscht, Axone und Mantelstruktur erhalten), Axonotmesis (Axone innerhalb der Hüllstruktur unterbrochen) und Neurotmesis (komplette Unterbrechung der Kontinuität) zu unterscheiden. Eine Differenzierung ist prognostisch von Bedeutung, weil eine Regeneration nur bei Kontinuität möglich ist. Die Regenerationsgeschwindigkeit peripherer Nerven liegt unter optimalen Voraussetzungen bei etwa 1mm pro Tag.6
Der individuelle Gesichtsausdruck wird durch ein komplexes neuro- und psychomotorisches Zusammenspiel dynamisch bestimmt, welches Gefühle in willkürliche und unwillkürliche Mimik umwandelt.7 Mimik ist das stärkste nonverbale Kommunikationsinstrument und gleichzeitig ehrlicher Spiegel der inneren emotionalen Situation. Die mimischen Ausdrücke beschreiben durch ihre hohe Variabilität und Individualität den Charakter des Menschen.
Fazialisparese
Patienten mit partieller oder vollständiger Gesichtslähmung leiden an schweren funktionellen und ästhetischen Einschränkungen. Durch die Lähmung werden sie in ihrem Selbstwertgefühl und im Vermögen zur sozialen Interaktion beschränkt.8
Epidemiologie
Die Prävalenz von Fazialisparesen schwankt zwischen 17 und 35/100000 Einwohnern für alle Formen.9–11 In westlichen Ländern wird ca. 1/2500 Personen pro Jahr und 1/60 Personen in ihrer Lebenszeit eine Bell-Parese entwickeln.12 Bislang konnte keine signifikante Prädilektion bzgl. Herkunft, Geschlecht oder Ethnizität festgestellt werden.13
Ursachen
Die Bell-Parese, benannt nach dem schottischen Chirurgen Sir Charles Bell (1774–1842), ist die häufigste idiopathische Fazialisparese.14 Es wird angenommen, dass eine virale Infektion zum Anschwellen des Nervs im Canalis nervi facialis führt.15 Als Auslöser der Entzündung werden Autoimmunreaktionen oder die Reaktivierung einer Herpes-simplex-Virus-Infektion (HSV Typ 1) postuliert.16 Weitere Ursachen sind u.a. Tumorleiden (z.B. Akustikusneurinom), Operationen, iatrogene Verletzungen, Traumata, kongenitale Genesen, Lyme-Borreliose und seltene Syndrome (z.B. Möbius-Syndrom, Melkersson-Rosenthal-Syndrom).
Formen
Generell differenziert man zwischen einem zentralen und einem peripheren Lähmungstyp und einer irreversiblen und einer sich spontan zurückbildenden Parese. Mischformen existieren. Von Irreversibilität spricht man nach Ablauf von etwa 18 Monaten nach Erstmanifestation ohne Besserungszeichen. Komplette werden von inkompletten Fazialisparesen unterschieden. Paresen können anhand ihrer Verlaufsform als akut oder chronisch wie auch nach ihrem Ausprägungstyp als spastisch oder schlaff kategorisiert werden. Beim «Hemispasmus facialis» kommt es zu unwillkürlichen Muskelkontraktionen.17 Unwillkürliche Mitbewegungen und Massenbewegungenen nicht an der beabsichtigten Bewegung beteiligter Muskelgruppen werden Synkinesien genannt.
Symptome
Korrespondierend mit dem Ausfall der Fazialisnervenäste und der entsprechend innervierten Muskulatur finden sich als Symptome ein Ausfall des Stirnmuskels mit Brauenptose (R. frontalis), Lagophthalmus (fehlender Lidschluss) und Konjunktivitis (R. zygomaticus), hängender Mundwinkel mit oraler Inkontinenz und verwaschener Sprache bei schlaffem Wangengewebe (zygomaticobuccales Astsystem) sowie eine fehlende Lippen- und Mundwinkelsenkung (R. marginalis mandibulae). Eine Zusammenfassung gibt Tabelle 1 wieder. Der unvollständige Lidschluss zeigt das pathologische Bell-Zeichen: Die Aufwärtsbewegung des Augapfels wird auf der betroffenen Seite beim Versuch, die Augen zu schliessen, sichtbar. Ein paretischer Augenkomplex kann zu einer Keratokonjunktivitis führen, die eine Erblindung zur Folge haben kann. Während Kinder und Jugendliche häufig noch eine kompensierte Ruhesymmetrie aufweisen, nimmt die Asymmetrie in Ruhe mit steigendem Alter zu. Beim Lächeln/Lachen verstärkt sich die Asymmetrie meist deutlich. Beim älteren Patienten gesellen sich häufig eine erschwerte Nasenatmung und beim Kauprozess rezidivierende Verletzungen der Wangenschleimhaut durch unbeabsichtigtes Aufbeissen hinzu.
Patienten mit Fazialisparese haben eine Prävalenz von 65% für Depressionen, was dem Fünffachen der Prävalenz bei der nicht selektierten Bevölkerung entspricht.18 Kosins et al. von der Facial Palsy Clinic in Edinburgh, Schottland, beschrieben an einem Kollektiv von 22954 Patienten bei über 50% ein beträchtliches Niveau an psychischem Stress sowie konkrete Tendenzen zum Rückzug aus der Gesellschaft.19,20
Scores
Weitverbreitet ist die Klassifikation nach House und Brackmann.20 Sie teilt die Schwere der Parese in sechs Grade ein. Des Weiteren hat sich das «Sunnybrook Facial Grading System» etabliert.21 Es weist eine hohe Sensitivität und Reliabilität in der Beurteilung von Ruhesymmetrie, Symmetrie in der Bewegung und Synkinesien auf.22–24 Auch neuere computergestützte Scores wie «eFACE» werden immer populärer.25,26
Prognose und Indikationsstellung («time is muscle»)
Die meisten spontanen Gesichtslähmungen verschwinden von selbst wieder. In 71% der Fälle bleiben keine Folgeschäden, 84% der Patienten gewinnen eine annähernd normale Funktion zurück.9,27 Die verbliebenen Patienten leiden oft jedoch erheblich unter ihren Symptomen. Die Schwere der Ausprägung bei Erstauftreten ist von entscheidender prognostischer Bedeutung. Fujiwara et al. zeigten an einer grossen Patientenserie mit Bell-Paresen, dass als alleiniger Prognosefaktor das Ausmass der Funktionsdefizite eine Woche nach Erstauftreten zu sehen ist.28 D.h., je gravierender sich die Symptomatik eine Woche nach Auftreten darstellt, desto ungünstiger ist die Prognose für den zu erwartenden Funktionsrückgewinn. Tritt zu der Bell-Parese nur eine partielle Lähmung auf, so zeigten in der Studie 94% der Patienten innerhalb von vier Monaten eine vollständige Rückbildung. Präsentierte sich jedoch von Anfang an eine vollständige Gesichtslähmung, ergab sich im Verlauf in nur 61% der Fälle eine Rekonvaleszenz. Ein Anteil von 39% der Patienten hatte hingegen permanente Funktionsausfälle zu beklagen. In 16% zeigte sich keine ausreichende Reinnervation, sodass Synkinesien und/oder autonome Störungen (z.B. Phänomen der Krokodilstränen) und/oder Kontrakturen auftraten.29
Die Dauer der Denervierung ist wahrscheinlich der bedeutendste prognostische Faktor für den Erfolg einer Rekonstruktion mit dem Ziel einer Reinnervation. Es gilt das «Time is muscle»-Prinzip, denn nach Ablauf eines Zeitraums von etwa 15–18 Monaten ohne nerval vermittelte Aktivität der mimischen Muskulatur ist diese wegen der fehlenden Stimulation unwiderruflich geschwächt. Extratemporale Fazialisnervenäste in Diskontinuität sollten daher sofort direkt oder per Nerveninterposition mikrochirurgisch adaptiert werden.30 Das prädiktive Modell von Rivas et al. beschreibt anhand der Rate an Funktionsrückgewinn ein schlechtes Outcome in 50% der Fälle innerhalb des 1. Jahres mit einer Sensitivität von 97% und einer Spezifität von 97%.31 Ist der Nerv in contiuitatem, sollte gefolgert werden, dass bei Ausbleiben einer Verbesserung von zumindest einer Stufe auf der House-Brackmann-Scala innerhalb von 6 Monaten nach Erstdiagnose ein Neurotisationsverfahren geplant werden kann.29,30,32,33 Die Neurotisation beschreibt den Vorgang, einen intakten, jedoch denervierten Muskel mit einem Spendernerv zu reinnervieren, z.B. durch eine Cross-face-Nerventransplantation (CFNG) oder einen Nerventransfer.34 Neurotisierende Verfahren, die noch bestehende mimische Muskulatur reanimieren, können alle 21 mimischen Muskeln reaktivieren und sind weniger invasiv als motorische Ersatzplastiken oder freie Muskeltransplantationen, die in der chronischen Phase (mimische Muskulatur atroph) angewendet werden. Folglich kann bei Patientenzuweisungen zur plastisch-chirurgischen Rekonstruktion zu einem späteren Zeitpunkt als 12 Monate nach Beginn der Parese das funktionelle Resultat eingeschränkt sein, da verbleibende Defektzustände zu erwarten sind.29 Ist ein chronisches Stadium (18 Monate nach Eintritt der Lähmung ohne Besserungszeichen) erreicht, gilt die mimische Muskulatur als nicht mehr zu «reanimieren», da sie bei fehlender Nervenreizung zu Fettgewebe umgewandelt wird.35
Plastisch-chirurgische Rekonstruktion
Die Wiederherstellung nach Fazialisparese gilt als anspruchsvoller Spezialbereich der plastischen Chirurgie. Entsprechend sollten Rekonstruktionen im Kopf-/Halsbereich nur in speziell dafür ausgelegten Zentren durchgeführt werden. Behandelnde Chirurgen müssen sich intensiv mit der Mikro- und Makroanatomie des Fazialisnervs und der geeigneten Spendernerven auseinandergesetzt haben und mikrochirurgische Techniken sowie Rekonstruktionen mit freien Muskeltransplantaten sicher beherrschen.
Statische Korrekturen beinhalten Straffungsoperationen, Aufhängeplastiken, Lidkorrekturen, Implantationen von Gold-/Platingewichten zur Oberlidbeschwerung, Einbringung von Eigengewebe zur Verbesserung der Nasenatmung, Behebung der oralen Inkontinenz und Asymmetrie. Dynamische Operationen hingegen umfassen die Wiederherstellung des Augenschlusses und der Mundwinkelhebung durch motorische Ersatzplastiken, Nerventransplantationen und -transfers sowie freie funktionelle Muskeltransplantationen. Häufig werden Verfahren kombiniert, um das Ergebnis zu optimieren.
Statische Rekonstruktion
Die Wiederherstellung der Symmetrie und Funktion kann mittels Implantation von Sehnen- oder Faszienzügel an Mundwinkel und Oberlippe, Unterlid und/oder zur erleichterten Atmung im Bereich des Nasenflügels, durch Eigenfetttransplantationen, durch Gewichtsimplantate im Oberlid und weitere Verfahren erfolgen. Der Einsatz von Botulinumtoxin zur Symmetrisierung oft hyperspastischer Muskelgruppen der Gegenseite und bei Synkinesien zählt ebenfalls zu den Standards.
Im Jahr 1950 wurde die Methode des Augenlidimplantats von Sheehan zur Behandlung des insuffizienten Lidschlusses vorgestellt.36 Zur Beschwerung wird ein flaches Gold- oder Platinimplantat in das Oberlid eingebracht. Die gewünschte partielle Ptosis erleichtert einen aktiven Lidschluss.37 Im Vordergrund stehen hier der Schutz des Auges und die ausreichende Benetzung der Hornhaut mit Tränenflüssigkeit.
Die Rekonstruktion des Unterlidektropiums verbessert den Tränenfluss und schützt das Auge z.B. vor Konjunktividen.38,39 Es stehen hier verschiedene operative Methoden zur Verfügung. Eine Unterlidkanthopexie bzw. -plastik wie die «lateral tarsal strip procedure» nach Anderson und Gordy kann Abhilfe schaffen.40 Bei starker Laxizität sollte das Unterlid durch die Einbringung dünnster Sehnen- (z.B. Palmaris-longus-Sehne) oder Faszienstreifen (Fascia lata vom Oberschenkel) gestrafft werden.41–44 Verengt ein herabhängender Brauenkomplex die Lidspalte bzw. das Sichtfeld, kann eine Korrektur durch eine direkte oder indirekte Brauenanhebung erfolgen.45Wann immer möglich, sollten dynamische Lösungen den rein passiven vorgezogen werden.46
Wichtig ist, im Falle einer Parese des Stirnastes des N. facialis (Ramus frontalis) die Symmetrie der Augenbrauenposition wiederherzustellen. Nicht allein, weil die herabhängende Braue das Gesichtsfeld einschränkt. Der Mensch nimmt bereits eine Abweichung von nur 3 mm wahr, daher hat die Symmetrie einen hohen subjektiven Stellenwert in der Patientenzufriedenheit.47
Nerventransfers zur Neurotisation
Wann immer möglich, sollten dynamische Lösungen den rein passiven vorgezogen werden.47 Die besten Ergebnisse werden in der frühzeitigen Behandlung von Gesichtsgelähmten erzielt. Es gilt das «Time is muscle»-Prinzip (siehe oben). Denn wird im therapeutisch günstigen Fenster zwischen 6 und 12 (maximal 15) Monaten nach Erstmanifestation eine Neurotisation durchgeführt, kann in der gelähmten Gesichtshälfte die gesamte mimische Muskulatur auch ohne funktionierenden Fazialisnerv erhalten werden und möglicherweise ihre ursprüngliche, detailreiche Funktion wieder aufnehmen.
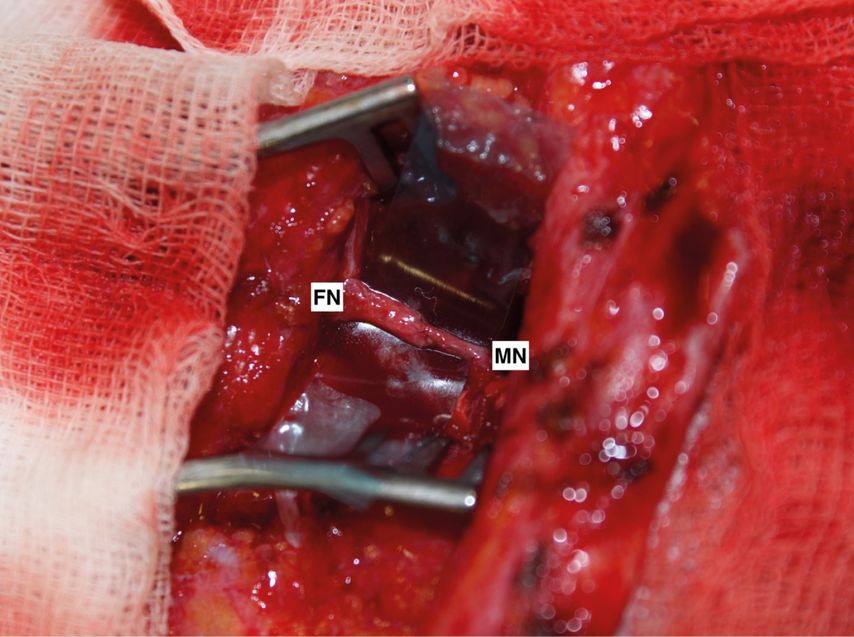
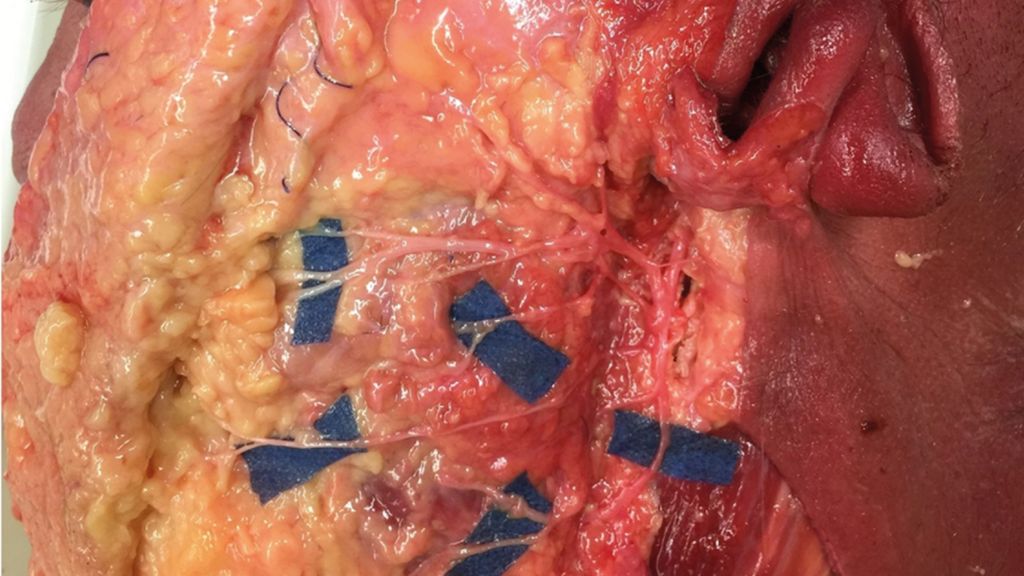
Um eine Neurotisation der originären Muskulatur zu erzielen, können diverse Spendernerven herangezogen werden. Es kommen unter anderem der N. hypoglossus,47–49 der N. accessorius50,51 und der N. massetericus (Radix motoria n. trigemini)52,53 in Betracht. Von grosser Bedeutung ist hierbei, einen Nervenast mit einer adäquaten Axonkapazität zu wählen.54, 55 In jüngerer Vergangenheit hat sich in der rekonstruktiven Chirurgie aufgrund einer geringeren Morbidität ein deutlicher Trend weg von N. hypoglossus und anderen Spendernerven hin zum N. massetericus gezeigt.56,57 Die Neurotisation mit einem Ast des N. massetericus wird im englischen Sprachgebrauch analog zu den Hirnnervenbezeichnungen «V-to-VII transfer» genannt.55 Abbildung 2 demonstriert den entsprechenden Nerventransfer an den Hauptstamm des N. facialis. Die Rekonstruktion eines natürlichen Lächelns ist mit dieser Methode möglich.58 Nicht zuletzt trägt die Plastizität des Gehirns dazu bei.59 Einige Patienten können nach diesem operativen Verfahren auch bewusst zwischen der Ansteuerung des Kaumuskels und der Ansteuerung der mimischen Muskulatur unterscheiden.60 Die Kaufunktion bleibt dabei erhalten. Mithilfe des Kaumuskelnervs kann in manchen Fällen ein emotionales oder spontanes Lächeln prouziert werden.62 Nachteile dieser Methode können Synkinesien während des Kauprozesses sein. Spontanität und emotionale Kopplung sind nicht so verlässlich zu erwarten wie bei Verwendung von CFNG (Nervus facialis der gesunden Gesichtshälfte als Spendernerv, siehe unten). Daher wird häufig eine Kombination aus beiden Verfahren angestrebt.63
Abb. 2:Massetericus-Nerventransfer an der Universitätsklinik Regensburg. Beim sogenannten «V-to-VII nerve transfer” werden Äste des N. massetericus an den ipsilateralen N. facialis transferiert. Hier ist eine Koaptation eines Unterastes des N. massetericus (MN) an den extratemporalen Hauptstamm des N. facialis (FN) in der linken Gesichtshälfte bei vollständiger, früher Parese zu sehen. FN: N.-facialis-Hauptstamm, MN: N. massetericus
«Cross-face nerve graft» (CFNG)
Ein nützliches Instrument zur fazialen Reanimation ist die Reinnervation über ein CFNG mittels Fazialisnerv der Gegenseite. Als Erstbeschreiber der Methode gelten Scaramella et Smith in den 1970er-Jahren.61,62 Im Rahmen dieses Ansatzes wird ein korrespondierender Ast des funktionsfähigen Fazialisnervs der nicht paretischen Gesichtshälfte durchtrennt und mit einem Suralis-Nerventransplantat auf die paretische Seite verlängert. An jeder End-zu-End-Koaptationsstelle ist mit einem Verlust von etwa 50% der einspriessenden Axone zu rechnen. Je nach Länge des erforderlichen Nerventransplantates und einer weiteren Nervennaht distal ist also nur mit 20–25% der ursprünglichen Spenderaxone zu rechnen.63 Folglich sind fundierte mikro- und makroanatomische Kenntnisse hinsichtlich der Axonkapazitäten verschiedener Spendernerven unerlässlich. Nur so kann die optimale Wahl eines Spendernervs mit suffizienter motorischer Potenz, jedoch ohne ipsilaterale Schwächung der mimischen Muskulatur getroffen werden.
CFNG können verschiedene Aufgaben übernehmen. Durch sie kann noch bestehende mimische Muskulatur des Augen-/ Nasen-/Wangen- oder Mundkomplexes im frühen Intervall der Fazialisparese wieder reaktiviert werden. Ist in der Therapie der irreversiblen chronischen Fazialisparese eine freie, funktionelle Muskeltransplantation geplant, so kann ein zuvor transplantiertes CFNG als Anschlussmöglichkeit mit hohem Potenzial an Spontanität und emotionaler Kopplung dienen.61
Motorische Ersatzplastiken
Auch nach Ablauf des kritischen Zeitfensters von 6 bis 12 (maximal 15) Monaten nach Erstmanifestation gibt es zum Erhalt der originären mimischen Muskulatur noch eine Vielzahl an Möglichkeiten. Ist ein Nerventransfer nicht mehr möglich, kann mit der Einbringung von Eigengewebe, der Durchführung von motorischen Ersatzplastiken (z.B. Umlagerung eines Teils der Temporalis-Kaumuskulatur ohne Funktionsverlust der Kaufähigkeit) oder der freien Transplantation funktionierender Muskeln den Patienten wieder zu ansprechender Symmetrie und viel Dynamik (Bewegung, Reaktionsvermögen) im Gesicht verholfen werden.
Der erste Muskeltransfer zur Rekonstruktion nach Fazialisparese geht auf den deutschen Chirurgen Erich Lexer (1906) zurück.64 Sir Harold Gillies beschrieb 1934 eine ähnliche Operationsmethode zur Umlagerung eines Muskelsegmentes des M. temporalis, welches mit einem Fascia-lata-Transplantat vom Oberschenkel einen funktionellen Ersatz für den paretischen M. orbicularis oculi und damit einen dynamischen Augenschluss herstellt.65 1952 entwickelte Charles McLaughlin die motorische Ersatzplastik weiter.66 In den 1970er-Jahren wurden Techniken, die die Fascia-lata-Transplantate vermeiden, beschrieben.67–69
Bei der «lengthening temporalis myoplasty» nach Labbé wird der Muskelursprung nach anterior verlagert und der Arcus zygomaticus osteotomiert.70 Durch willkürliche Okklusion der Zähne wird ein symmetrisches Lächeln angestrebt. Insbesondere beim älteren Patienten mit unzureichendem Potenzial an Nervenregeneration empfehlen sich Muskelersatzplastiken aufgrund ihrer relativ geringen Komplikationsraten.71
Freie Muskeltransplantation
Die ersten erfolgreichen freien funktionellen Muskeltransplantationen zur Reanimation nach peripherer Fazialisparese wurden bereits 1976 von Harii et al. durchgeführt.72 Zur Transplantation eignen sich prinzipiell der M. latissimus dorsi,73 der M. pectoralis minor74 sowie weitere. Bei der Wahl des Muskeltransplantats müssen u.a. Faktoren wie Muskelvolumen, -grösse, versorgendes Gefäss-Nerven-Bündel, Kontraktionsamplitude, Muskelkraft und Erreichbarkeit der geplanten Koaptation und des Gefässanschlusses bedacht werden. Die freie Muskeltransplantation gilt mittlerweile als Goldstandard zur Reanimation bei jungen Patienten sowie Betroffenen mittleren Alters.75,76 Die Reinnervation des Muskels dauert typischerweise etwa fünf bis zwölf Monate. Abbildung 3 zeigt eine Vorher-nachher-Bildserie eines jungen Patienten.
Abb. 3: Linkes Bild: angeborene Gesichtslähmung rechts bei einem 8-jährigen Jungen. Beim Lächeln kommt es zu einer ausgeprägten Entstellung durch die Asymmetrie. Rechtes Bild: Wenige Monate nach freier funktioneller Muskeltransplantation ist bereits ein symmetrisches Lächeln durch die dynamische Rekonstruktion möglich. Der intelligente Junge setzt seine neue Muskelfunktion bereits «unwillkürlich» ein und hat sie unbewusst in die Mimik der nichtgelähmten linken Gegenseite integriert. Eine leichte Schwellung rechts wird im weiteren Verlauf noch rückläufig sein. Die Gefahr von Hänseleien in der Schule sollte durch die erfolgreiche «Reanimation» der ehemals gelähmten Gesichtshälfte gebannt sein
In einzeitigen Rekonstruktionsverfahren wird als Spendernerv für die freie Muskeltransplantation hauptsächlich der N. massetericus verwendet. Einzeitige Verfahren eignen sich z.B. bei explizitem Patientenwunsch oder bei bilateralen Paresen ohne intakten Fazialisnerv. Bilaterale Paresen treten zum Beispiel im Rahmen des angeborenen Möbius-Synydroms auf.71 Hier braucht es Alternativen zum CFNG.72,73 Bezüglich Spontanität und emotionaler Koppelung gelten die gleichen Prinzipien wie beim Nerventransfer.
Literatur:
1 Freilinger G et al.: Plast Reconstr Surg. 1987; 80(5): 686-90 2 Happak W et al.In: Stennert E et al. (Hg.): The Facial Nerve. Berlin; Springer 1994: 85-6 3 Farahvash MR et al.: Aesthet Surg J 2010; 30(1): 17-21 4 Tzafetta K, Terzis JK: Plast Reconstr Surg 2010; 125(3): 879-89 5 Kehrer A et al. :Clin Anat 2018; 31(4): 560-5 6 Buchthal F, Kuhl V.: J Neurol Neurosurg Psychiatry 1979; 42(5): 436-51 7 Kehrer A et al.: Clin Hemorheol Microcirc 2017; 67(3-4): 435-44 8 Huang B et al.: J Huazhong Univ Sci Technolog Med Sci 2012; 32(2): 272-9 9 Peitersen E.: Acta Otolaryngol Suppl 2002; 549: 4-30 10 Devriese PP et al.: Clin Otolaryngol Allied Sci 1990; 15(1): 15-27 11 Katusic SK et al.: Ann Neurol 1986; 20(5): 622-7 12 McCaul JA et al.: Br J Oral Maxillofac Surg 2014; 52(5): 387-91 13 Adour KK et aI.: 88(5): 787-801 14 Holland NJ, Weiner GM: BMJ 2004; 329(7465): 553-7 15 Glass GE, Tzafetta K.: Fam Pract 2014; 31(6): 631-42 16 Murakami S et al.: Ann Intern Med 1996; 124(1 Pt 1): 27-30 17 Rosenstengel C et al.: Dtsch Arztebl Int 2012; 109(41): 667-73 18 VanSwearingen JM et al.: Aesthetic Plast Surg 1999; 23(6): 416-23 19 Kosins AM et al.: Can J Plast Surg 2007; 15(2): 77-82 20 House JW, Brackmann DE: Otolaryngol Head Neck Surg 1985; 93(2): 146-7 21 Ross BR et al.: Eur Arch Otorhinolaryngol 1994: S180-1 22 Ahrens A et al.: Am J Otol 1999; 20(5): 667-71 23 Kayhan FT et al.: Otolaryngol Head Neck Surg 2000; 122(2): 212-5 24 Chee GH, Nedzelski JM: Facial Plast Surg 2000; 16(4): 315-24 25 Banks CA et al.: Plast Reconstr Surg 2015; 136(2): 223e-30e 26 Banks CA et al.: Plast Reconstr Surg 2017; 139(2): 491e-8e 27 Peitersen E: Am J Otol 1982; 4(2): 107-11 28 Fujiwara T et al.: Eur Arch Otorhinolaryngol 2014; 271(7): 1891-5 29 Heckmann J et al.: S2k-Leitlinie Therapie der Idiopathischen Fazialisparese (Bell’s Palsy). AWMF-Registernummer 030-013; verfügbar unter http://www.awmf.org/leitlinien/detail/ll/030-013.html (zuletzt aufgerufen am 12.11.2024) 30 Boahene K.: F1000Prime Rep 2013; 5: 49 31 Rivas A et al.: Otol Neurotol 2011; 32(5): 826-33 32 Biglioli F.: Br J Oral Maxillofac Surg 2015; 53(10): 901-6 33 Yoshioka N, Tominaga S.: J Plast Reconstr Aesthet Surg 2015; 68(6): 764-70 34 Garcia RM et al.: Plast Reconstr Surg 2015; 135(6): 1025e-46e 35 Klebuc M, Shenaq SM: Semin Plast Surg 2004; 18(1): 53-60 36 Sheehan JE: Surgery 1950; 27(1):122-5 37 Rahman I, Sadiq SA: Surv Ophthalmol 2007; 52(2): 121-44 38 McMonnies CW: Cont Lens Anterior Eye 2007; 30(1): 37-51 39 Fedok FG, Ferraro RE: Facial Plast Surg 2000; 16(4): 337-43 40 Moe KS, Linder T: Arch Facial Plast Surg 2000; 2(1): 9-15 41 Terzis JK, Kyere SA: Plast Reconstr Surg 2008; 121(4): 1206-16 42 Collin JR: Br J Plast Surg 1993; 46(2): 149-50 43 McLaughlin CR: Br J Plast Surg 1950; 3(2): 87-95 44 McLaughlin CR: Br J Plast Surg 1993; 46(2): 143-8 45 Terzis JK, Karypidis D: Plast Reconstr Surg 2010; 126(1): 126-39 46 Murphey AW et al.: JAMA Facial Plast Surg 2018; 20(2): 104-10 47 Millesi H: Clin Plast Surg 1979; 6(3): 333-41 48 Hernandez-Pascual L: J Neurosurg 1995; 83(4): 762-3 49 Terzis JK, Tzafetta K: Plast Reconstr Surg 2009; 123(3): 865-76 50 Chuang DC et al: Ann Plast Surg 2018; 81(6S Suppl. 1): S21-9 51 Ebersold MJ, Quast LM: J Neurosurg 1992; 77(1): 51-4 52 Brenner E, Schoeller T: Clin Anat 1998; 11(6): 396-400 53 Borschel GH et al.: J Plast Reconstr Aesthet Surg 2012; 65(3): 363-6 54 Snyder-Warwick AK et al.: Plast Reconstr Surg 2015; 135(2): 370e-81e 55 Klebuc M: Ann Chir Plast Esthet 2015; 60(5): 436-41 56 Manni JJ et al.: Am J Surg 2001; 182(3): 268-73 57 Lenzen-Schulte M: Dtsch Arztebl International 2018: 1170-3 58 Klebuc MJ: Plast Reconstr Surg 2011; 127(5): 1909-15 59 Manktelow RT et al.: Plast Reconstr Surg 2006; 118(4): 885-99 60 Hontanilla B, Marre D: Head Neck 2014; 36(8): 1176-80 61 Scaramella LF: Arch Ital Otol 1971; 82: 209-16 62 Smith JW: Transactions of the Fifth International Congress for Plastic and Reconstructive Surgery. Chadwick, New South Wales, Australia: London: Butterworths Ltd.; 1971 63 Grinsell D, Keating CP: Biomed Res Int 2014; 2014: 698256 64 Lexer E: Beiträge zur klinischen Chirurgie 1906; 11: 116-26 65 Gillies H: Proc R Soc Med 1934; 27(19): 1372-82 66 McLaughlin CR: Lancet 1952; 2(6736): 647-51 67 Gordin E et al.: Craniomaxillofac Trauma Reconstr 2015; 8(1): 1-13 68 Baker DC, Conley J: Clin Plast Surg 1979; 6(3): 317-31 69 Rubin L. Reanimation of the paralyzed face: New approaches. St. Louis: Mosby; 1977 70 Labbe D, Huault M: Plast Reconstr Surg 2000; 105(4): 1289-97; discussion 98 71 Ozturan O et al.: J Craniofac Surg 2015; 26(6): e515-7 72 Harii K et al.: Plast Reconstr Surg 1976; 57(2): 133-43 73 Takushima A et al.: J Plast Reconstr Aesthet Surg 2013; 66(1): 29-36 74 Harrison DH, Grobbelaar AO: J Plast Reconstr Aesthet Surg 2012; 65(7): 845-50 75 Terzis JK, Olivares FS: Plast Reconstr Surg 2009; 123(3): 877-88 76 Terzis JK, Olivares FS: Plast Reconstr Surg 2009; 123(2): 543-55 77 Kehrer A et al.: Clin Anat 2018; 3(4): 560
Das könnte Sie auch interessieren:
Der Paranasallappen zur Rekonstruktion des Unterlides
Die anatomische und funktionelle Wiederherstellung des Unterlides bei ausgedehnten und allschichtigen Defekten nach Tumorerkrankungen oder Unfällen ist anspruchsvoll. Sie erfordert den ...
Optimierung des direkten Brauenliftings
Ein direkter Brauenlift bietet oft die präziseste und langfristigste Lösung, wenn es darum geht, eine abgesunkene Braue ästhetisch anzuheben. Gerade bei asymmetrischen oder künstlich ...
Gesichtswiederherstellung nach Hautkrebsoperationen
Hautkrebsoperationen im Gesicht erfordern eine präzise Rekonstruktion, die sowohl ästhetischen als auch funktionellen Ansprüchen gerecht wird. Dieser Artikel beleuchtet die wichtigsten ...