Paradigmen-Wechsel bei chronischen Schmerzzuständen
Autor*innen:
Prof. Dr. med. Ulrich T. Egle
Dr. med. Sabine Quill
Christian Seeher
Prof. Dr. med. Katja Cattapan
Psychiatrische Privatklinik Sanatorium Kilchberg
Korrespondierender Autor:
Prof. Dr. med. Ulrich T. Egle
Bei chronischen Schmerzzuständen ist aktuell in mehrfacher Hinsicht ein weitreichender Paradigmenwechsel im Gange. Dies betrifft deren Klassifikation im neuen ICD-11, die Mechanismen der Verarbeitung im Gehirn sowie die Verordnung von Opioiden als wesentliche Therapiestrategie.
Keypoints
-
Im neuen ICD-11 gibt es für chronische Schmerzzustände eine eigene Krankheitskategorie, die zwischen primären und sekundären Schmerzstörungen unterscheidet.
-
Das Fibromyalgie-Syndrom wird danach unter chronischen ausgedehnten Schmerzzuständen (MB30.01) subsummiert und verschwindet als eigenständiges Krankheitsbild.
-
Das wissenschaftliche Verständnis des Gehirns im Umgang mit Sinneseindrücken hat sich grundlegend verändert, was auch Auswirkungen auf die zentrale Schmerzgenese und -verarbeitung hat.
-
Dies hat weitreichende Auswirkungen auf die Schmerztherapie, nicht zuletzt auf die Verordnung von Opioiden, wo die Schweiz inzwischen eine weltweit führende Position einnimmt.
Chronischer Schmerz in der neuen ICD-11-Klassifikation
Nachdem Schmerz in der Medizin bisher bei zahlreichen Krankheitsbildern ausschliesslich als Symptom gesehen wurde, wurden chronische Schmerzzustände (≥3 Monate) in die von der WHO zum 1.1.2022 in Kraft gesetzte ICD-11 als eigenständige Krankheitsgruppe (MG30) aufgenommen.
Unterschieden wird dabei zwischen sekundären, bei denen eine nozizeptive oder neuropathische Genese nachgewiesen werden kann, und primären Schmerzzuständen, denen eine solche periphere Verursachung fehlt. Diese werden vor allem durch zentrale Prozesse generiert („noziplastisch“) und gehen klinisch meist mit einer psychischen und/oder sozialen Problematik einher.
Die neue Klassifikation führt auch dazu, dass das Fibromyalgie-Syndrom nicht nur aus der Gruppe der rheumatologischen Erkrankungen verschwunden ist, sondern der Begriff im ICD-11 überhaupt nicht mehr zu finden ist. Subsumiert wird diese multilokuläre Schmerzsymptomatik, deren Definition Jahrzehnte kontrovers diskutiert wurde, künftig als chronisches ausgedehntes Schmerzsyndrom („chronic widespread pain“) bei den primären Schmerzzuständen (MG30.01).Diese Zuordnung priorisiert eine zentrale Schmerzgenese, schliesst die Relevanz nozizeptiver bzw. neuropathischer Faktoren in der Genese weitestgehend aus und betont die Bedeutung psychischer und sozialer Faktoren (vgl. Kasten).
Zentrale Schmerzverarbeitung und «predictive coding»
Während das Gehirn wissenschaftlich bis vor Kurzem noch als ein auf Sinneseindrücke reagierendes Organ verstanden wurde, wird es heute als ein aktives Organ gesehen, das sich nicht auf eine Reizreaktion beschränkt, sondern Vorhersagen und Hypothesen von Sensationen generiert («predictive coding»). Dabei werden die aktuelle körperliche und psychische Verfassung sowie soziale Einflussfaktoren und individuelle Prägungen in der persönlichen Lerngeschichte bis zurück in die Kindheit neurobiologisch integriert (im Bereich der vorderen Insula und des vorderen Gyrus cinguli). Das Gehirn führt dann eine Art Kompromissbildung zwischen erwartetem Reiz und realem Stimulus durch, d.h., es schafft eine subjektive Wirklichkeit innerhalb des Irrtumsbereichs.1,5 Dieses Prinzip ist bei der Adaptation an Herausforderungen («Allostase») nicht zuletzt auch für den Energieverbrauch des Gehirns deutlich ökonomischer.4 Bezogen auf den Schmerz bedeutet dies, dass es bei der Perzeption eines peripheren Reizes – ob nozizeptiv oder neuropathisch – zu einer Kompromissbildung vor dem Hintergrund der aktuellen biopsychosozialen Gesamtverfassung und ggf. von früheren Schmerzerfahrungen (z.B. körperliche Misshandlung oder unzureichende postoperative Schmerzversorgung in der Kindheit) kommt.2,7 Auch ohne peripheren Input kann es passieren, dass das Gehirn aufgrund solcher oder anderer kontextueller Verknüpfungen Schmerzen zentral generiert. Dies wird im ICD-11 als „noziplastisch“ bezeichnet. Diese Zusammenhänge sind den Betroffenen meist nicht bewusst und sollten im Rahmen einer biopsychosozialen Diagnostik und Therapieplanung aktiv exploriert werden.
Das Problem mit den Opiaten
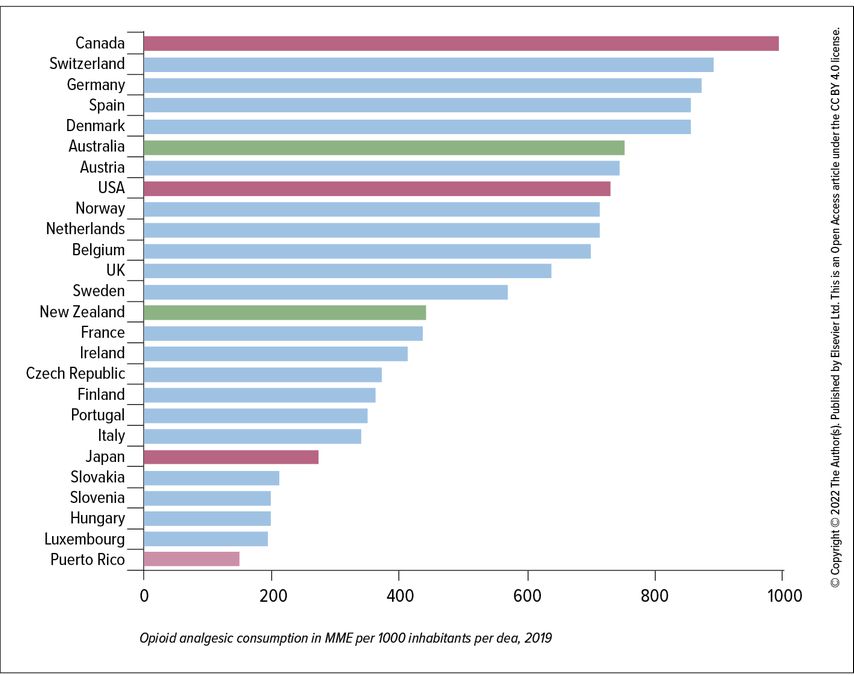
Bei chronischen Schmerzzuständen ohne nachweisbaren nozizeptiven oder neuropathischen Befund werden in der Schweiz als Ultima Ratio oft Opioide verordnet. Dabei zeigen Metaanalysen, dass diese im Mittel nur eine Schmerzreduktion von 10–12 Punkten (auf einer Skala von 0–100) bewirken können und damit Nicht-Opiaten (Schmerzreduktion 8,5 Punkte) kaum überlegen sind.6 Während es in den USA infolge der „Opioid-Krise“ bei der ärztlichen Verordnung von Opiaten zu einem erheblichen Rückgang gekommen ist, liegt die Schweiz mittlerweile pro Kopf der Bevölkerung weltweit an zweiter Stelle (umgerechnet in Morphineinheiten pro Tag), in Europa ist sie der Spitzenreiter (3, vgl. Abb. 1). Interessanterweise geht dieser hohe Verbrauch in erster Linie auf die Nordschweiz zurück, während die Rate in der französisch- und italienischsprachigen Schweiz vergleichsweise niedrig liegt.9 Eine längere Einnahme von Opiaten erhöht nicht nur das Risiko für Schlafstörungen und Abhängigkeit, sondern auch für die Entwicklung einer opiatinduzierten Hyperalgesie (OIH). Typische Kennzeichen sind eine sukzessive Schmerzzunahme und -ausweitung auf andere Körperareale, in deren Folge es dann oft auch zu einer Dosissteigerung kommt.8 Hier hilft nur eine stufenweise Dosisreduktion auf 0 über 10–14 Tage (in der Regel unter stationären Bedingungen) sowie eine personalisierte Therapiekonzeption unter Berücksichtigung der o.g. Mechanismen der Schmerzperzeption im Gehirn. Dieses biopsychosoziale Verständnis in Diagnostik und Therapie bedeutet allerdings einen erheblich grösseren Aufwand an Zeit und fächerübergreifender Kompetenz, was zunächst zu Verzögerungen bei der Umsetzung des skizzierten Paradigmenwechsels in der Versorgungspraxis führen dürfte.
Abb. 1: Weltweites Ranking nach Ländern des ärztlich verordneten Opioidverbrauchs in Morphineinheiten je Tag pro 1000 Einwohnern (Ju et al., 2022)3
Literatur:
1 Barrett FL, Simmons WK: Nat Rev Neurosci 2015; 16: 419-29 2 Hird EJ et al.: Sci Rep 2019; 9: 9443 3 Ju C et al.: Lancet Public Health 2022; 7: e335-46 4 Peters A et al.: Progress Neurobiol 2017; 156: 164-88 5 Picard F, Friston K: Neurology 2014; 83: 1112-8 6 Reinecke H et al.: Br J Pharmacol 2015; 172: 324-33 7 Tracey I: Nat Med 2010; 16: 1277-83 8 Yi P, Pryzbylkowski P: Pain Medicine 2015; 16: 32-6 9 Wertli MM et al.: BMC Health Serv Res 2017; 17: 167
Das könnte Sie auch interessieren:
Das «Feeling Safe»-Programm und eine neue postgraduale Fortbildungsmöglichkeit in der Schweiz
Evidenzbasierte Psychotherapie für Menschen mit Psychosen ist sehr wirksam. Sie gilt heute wie auch die Pharmakotherapie als zentraler Bestandteil einer modernen, Recovery-orientierten ...
Psychedelika in der Psychiatrie
Stellen Sie sich vor, Ihr Gehirn ist wie eine verschlungene Landkarte, auf der die immer gleichen Wege gefahren werden. Diese Strassen sind Ihre Denkmuster, Gefühle und Erinnerungen. ...
Klinische Interventionsstudie bei ME/CFS
An der Klinik für Konsiliarpsychiatrie und Psychosomatik des Universitätsspitals Zürich wird eine Sprechstunde für chronische Fatigue angeboten. Seit 2023 wird hier in Zusammenarbeit mit ...