<p class="article-intro">Der Verlust von „DNA mismatch repair“(MMR)-Proteinen führt zu einer Akkumulation von Mutationen im Genom, insbesondere in repetitiven DNA-Sequenzen, den sogenannten Mikrosatelliten.<sup>1</sup> Der Nachweis eines MMR-Defektes und/oder einer Mikrosatelliteninstabilität (MSI) dient der Identifikation von Patienten, welche von einer Immuncheckpoint-Inhibitor-Therapie profitieren, und von Personen mit dem erblichen Lynch-Tumor-Syndrom.<sup>2, 3</sup></p>
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Die Proteine MLH1, MSH2, MSH6 und PMS2 sind an der Reparatur („mismatch repair“) von fehlerhaften Basenpaarungen, Insertionen und Deletionen bei der DNA-Replikation während der Zellteilung beteiligt.</li> <li>Ein Verlust eines der „Mismatch repair“(MMR)-Proteine führt zur Akkumulation von Mutationen im Genom, insbesondere in repetitiven Sequenzen wie den Mikrosatelliten, und begünstigt damit die maligne Transformation von Zellen.</li> <li>Ein MMR-Defekt kann nur in Tumorzellen (somatisch) vorliegen oder seltener auf einer pathogenen Keimbahn-DNA-Sequenzvariante eines MMRGens beruhen (Lynch-Syndrom).</li> <li>Tumoren mit einem MMR-Defekt und konsekutiver Mikrosatelliteninstabilität (MSI) sprechen häufig auf Immuncheckpoint-Inhibitor-Therapie an.</li> </ul> </div> <h2>„DNA mismatch repair“</h2> <p>Während der Teilung einer Zelle passieren bei der DNA-Replikation ca. 100 000 Fehler durch Einbau falscher Nukleotide („mismatch“) sowie Insertionen und Deletionen.<sup>1</sup> Zellen weisen ein komplexes System interagierender Proteine zur Detektion und Reparatur der fehlerhaft replizierten DNA auf. In menschlichen Zellen sind an dem Prozess unter anderem die MMR-Proteine MutL Homolog 1 (MLH1), MutS Homolog 2 (MSH2), MutS Homolog 6 (MSH6) und „postmeiotic segregation increased 2“ (PMS2) beteiligt. Sie erkennen „mismatches“, rekrutieren andere DNA-Reparaturproteine sowie DNA-Polymerase und -Ligase zum Ort des DNA-Defektes und wirken bei der DNA-Reparatur mit.<br /> Ein Verlust eines „Mismatch repair“(MMR)-Proteins kann in Tumorzellen durch eine epigenetische Stilllegung von MLH1 und/oder eine Mutation in einem der MMR-Gene entstehen. Ein Defekt in einem der MMR-Proteine kann jedoch auch durch eine pathogene DNA-Sequenzvariante in der Keimbahn bedingt sein und die Ursache für das Lynch-Syndrom bzw. das hereditäre nicht Polyposis-assoziierte kolorektale Karzinom („hereditary nonpolyposis colorectal cancer“, HNPCC) darstellen.<sup>3</sup> Die am häufigsten mit einem Lynch-Syndrom assoziierten Tumoren sind das Kolon- und Endometriumkarzinom (jeweils 2–4 % der Fälle) sowie Tumoren des oberen Harntraktes und das Magenkarzinom.<sup>4–6</sup> Allerdings machen diese Tumorentitäten nur ca. 50 % aller mit Lynch-Syndrom assoziierten Neoplasien aus.<sup>7, 8</sup> In 70–90 % sind beim Lynch-Syndrom pathogene Sequenzvarianten in <em>MLH1</em> und <em>MSH2</em> vorhanden, seltener in <em>MSH6</em>, <em>PMS2</em> oder <em>„epithelial cell adhesion molecule“</em> (EPCAM). Insgesamt sind jedoch die nur in Tumorzellen auftretenden sporadischen MMR-Defekte, zumindest beim Kolon- und Endometriumkarzinom, circa 8- bis 10-mal häufiger als hereditäre MMR-Keimbahndefekte.</p>
<p class="article-intro">Der Verlust von „DNA mismatch repair“(MMR)-Proteinen führt zu einer Akkumulation von Mutationen im Genom, insbesondere in repetitiven DNA-Sequenzen, den sogenannten Mikrosatelliten.<sup>1</sup> Der Nachweis eines MMR-Defektes und/oder einer Mikrosatelliteninstabilität (MSI) dient der Identifikation von Patienten, welche von einer Immuncheckpoint-Inhibitor-Therapie profitieren, und von Personen mit dem erblichen Lynch-Tumor-Syndrom.<sup>2, 3</sup></p>
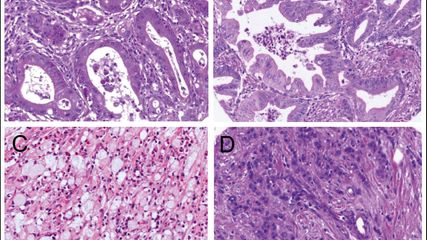
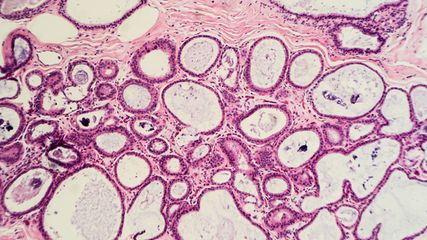
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Die Proteine MLH1, MSH2, MSH6 und PMS2 sind an der Reparatur („mismatch repair“) von fehlerhaften Basenpaarungen, Insertionen und Deletionen bei der DNA-Replikation während der Zellteilung beteiligt.</li> <li>Ein Verlust eines der „Mismatch repair“(MMR)-Proteine führt zur Akkumulation von Mutationen im Genom, insbesondere in repetitiven Sequenzen wie den Mikrosatelliten, und begünstigt damit die maligne Transformation von Zellen.</li> <li>Ein MMR-Defekt kann nur in Tumorzellen (somatisch) vorliegen oder seltener auf einer pathogenen Keimbahn-DNA-Sequenzvariante eines MMRGens beruhen (Lynch-Syndrom).</li> <li>Tumoren mit einem MMR-Defekt und konsekutiver Mikrosatelliteninstabilität (MSI) sprechen häufig auf Immuncheckpoint-Inhibitor-Therapie an.</li> </ul> </div> <h2>„DNA mismatch repair“</h2> <p>Während der Teilung einer Zelle passieren bei der DNA-Replikation ca. 100 000 Fehler durch Einbau falscher Nukleotide („mismatch“) sowie Insertionen und Deletionen.<sup>1</sup> Zellen weisen ein komplexes System interagierender Proteine zur Detektion und Reparatur der fehlerhaft replizierten DNA auf. In menschlichen Zellen sind an dem Prozess unter anderem die MMR-Proteine MutL Homolog 1 (MLH1), MutS Homolog 2 (MSH2), MutS Homolog 6 (MSH6) und „postmeiotic segregation increased 2“ (PMS2) beteiligt. Sie erkennen „mismatches“, rekrutieren andere DNA-Reparaturproteine sowie DNA-Polymerase und -Ligase zum Ort des DNA-Defektes und wirken bei der DNA-Reparatur mit.<br /> Ein Verlust eines „Mismatch repair“(MMR)-Proteins kann in Tumorzellen durch eine epigenetische Stilllegung von MLH1 und/oder eine Mutation in einem der MMR-Gene entstehen. Ein Defekt in einem der MMR-Proteine kann jedoch auch durch eine pathogene DNA-Sequenzvariante in der Keimbahn bedingt sein und die Ursache für das Lynch-Syndrom bzw. das hereditäre nicht Polyposis-assoziierte kolorektale Karzinom („hereditary nonpolyposis colorectal cancer“, HNPCC) darstellen.<sup>3</sup> Die am häufigsten mit einem Lynch-Syndrom assoziierten Tumoren sind das Kolon- und Endometriumkarzinom (jeweils 2–4 % der Fälle) sowie Tumoren des oberen Harntraktes und das Magenkarzinom.<sup>4–6</sup> Allerdings machen diese Tumorentitäten nur ca. 50 % aller mit Lynch-Syndrom assoziierten Neoplasien aus.<sup>7, 8</sup> In 70–90 % sind beim Lynch-Syndrom pathogene Sequenzvarianten in <em>MLH1</em> und <em>MSH2</em> vorhanden, seltener in <em>MSH6</em>, <em>PMS2</em> oder <em>„epithelial cell adhesion molecule“</em> (EPCAM). Insgesamt sind jedoch die nur in Tumorzellen auftretenden sporadischen MMR-Defekte, zumindest beim Kolon- und Endometriumkarzinom, circa 8- bis 10-mal häufiger als hereditäre MMR-Keimbahndefekte.</p> <h2>Hypermutation und Mikrosatelliteninstabilität</h2> <p>Die Folge eines MMR-Defektes ist die Akkumulation von Mutationen im Genom, wodurch es zur malignen Transformation von Zellen kommen kann. Die Mutationen sind über das gesamte Genom verteilt, allerdings treten Mutationen besonders häufig in Mikrosatelliten auf. Diese sind 10- bis 60-fache Wiederholungen von kurzen Sequenzen aus 1–6 Nukleotiden (Abb. 1). Mikrosatelliten sind im gesamten Genom in Intron- und Exonregionen sowie 5‘- und 3‘-nichttranslatierten Regionen verteilt und besonders anfällig für das Auftreten von Mutationen während der DNA-Replikation. Die Ansammlung von Mutationen in Mikrosatelliten resultiert in Mikrosatelliten unterschiedlicher Länge, einem Zustand, der als Mikrosatelliteninstabilität (MSI) bezeichnet wird.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Onko_1903_Weblinks_jatros_onko_1903_s61_abb1_oberndorfer.jpg" alt="" width="650" height="117" /></p> <h2>Warum sollen ein MMR-Defekt und/ oder eine dadurch verursachte MSI bestimmt werden?</h2> <p>Der Nachweis eines MMR-Defektes und/oder einer MSI ermöglicht die Identifikation von Patienten mit Lynch-Syndrom und damit eine Früherkennung von Tumoren, insbesondere bei Verwandten, welche auch die pathogene MMR-Genvariante in der Keimbahn aufweisen.<sup>8, 9</sup> Ferner sind Tumoren mit einer MSI häufig empfindlich gegenüber Immuncheckpoint- Inhibitor-Therapien.<sup>10</sup> Dies ist bedingt durch die hohe Mutationslast und die damit gesteigerte Ausbildung von Neoantigenen, welche vom Immunsystem als fremd erkannt werden. Zusätzlich ist es möglich, bei einem Kolonkarzinom mit MSI im Stadium II und der damit assoziierten guten Prognose von einer adjuvanten Chemotherapie Abstand zu nehmen.<sup>11</sup> Weiters kann der MSI-Status in ein Tumorgrading einfließen. Ein Tumor mit hoher MSI kann wegen des oft klinisch günstigen Verlaufes trotz histologisch niedriger Differenzierung (G3) als „Low grade“-Tumor klassifiziert werden.</p> <h2>Nachweis eines MMR-Defektes</h2> <p>Eine Screeningmethode zum Nachweis eines MMR-Defektes ist die Bestimmung der Expression von DNA-Reparaturproteinen in Tumorgewebe mittels Immunhistologie. Die Ergebnisse der Immunhistologie sind in über 92 % konkordant mit Ergebnissen einer molekularen Mikrosatellitenanalyse.<sup>12, 13</sup> Meist wird die Expression der MMR-Proteine MLH1, MSH2, MSH6 und PMS2 bestimmt. Bei der normalen nukleären Expression aller vier Proteine in Tumorzellen ist das Vorliegen einer MSI wenig wahrscheinlich. Ein Verlust der Expression von einem oder mehreren der MMR-Proteine ergibt den hochgradigen Verdacht auf das Bestehen einer MSI. Am häufigsten wird ein kombinierter Ausfall von MLH1 und PMS2 sowie seltener MSH2 und MSH6 beobachtet (Abb. 2).</p> <p>Dies ist durch eine die Proteinstabilität beeinflussende Komplexbildung der MMRProteine bedingt. Die Proteine PMS2 und MSH6 sind ohne ihre Partner MLH1 bzw. MSH2 instabil. Umgekehrt sind jedoch isolierte PMS2- oder MSH6-Verluste möglich, weil MLH1 und MSH2 auch ohne Bindungspartner stabil sind. Ein kombinierter Verlust von MLH1 und PMS2 ist meist somatisch, also auf die Tumorzellen beschränkt. Die Ursache ist überwiegend eine Methylierung des <em>MLH1</em>-Gen-Promotors, wodurch die Transkription von <em>MLH1</em> abgeschaltet wird. Allerdings kann auch eine Mutation (somatisch oder in der Keimbahn) ein Grund für den MLH1/ PMS2-Ausfall sein. Ein kombinierter Verlust von MSH2 und MSH6 ist eher mit einem Lynch-Syndrom assoziiert als durch eine somatische <em>MSH2</em>-Mutation bedingt. Isolierte Verluste von MSH6 oder PMS2 treten ebenfalls meist im Rahmen eines Lynch-Syndroms auf.<br /> Die Vorteile der MMR-Immunhistologie im Vergleich zu einer molekularen Mikrosatellitentestung sind die Verfügbarkeit in allen Instituten für Pathologie, die einfache und rasche technische Durchführung und die geringen Kosten. Ferner kann mit der Immunhistologie vereinzelt ein Verlust von MSH6 detektiert werden, bei normaler molekularer MSI-Testung, weil das Reparaturprotein MSH3 einen MSH6-Ausfall partiell kompensieren kann. Ein Nachteil der Immunhistologie sind eventuell vereinzelt falsch aberrant klassifizierte Fälle, aus technischen Gründen und/oder aufgrund der Diagnosestellung mit sehr kleinen Biopsien, welche angesichts heterogener Expression der MMR-Proteine in Tumorgewebe falsch negativ interpretiert werden können. Ferner kann eine MMR-Immunhistologie vereinzelt einen MMR-Defekt nicht anzeigen, wenn die Mutation die Stabilität des MMR-Proteins nicht signifikant vermindert und das Protein daher noch mittels Immunhistologie detektiert wird.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Onko_1903_Weblinks_jatros_onko_1903_s62_abb2_oberndorfer.jpg" alt="" width="2150" height="1793" /></p> <h2>Nachweis einer MSI</h2> <p>Die Untersuchung von Mikrosatelliten auf Mutation beziehungsweise Instabilität erfolgt durch eine PCR-Amplifikation von Mikrosatelliten. Der derzeit am breitesten etablierte Assay der Firma Promega analysiert fünf verschiedene Mononukleotid- Mikrosatelliten. Bei Bestehen einer Mikrosatelliteninstabilität weisen die Mikrosatelliten durch falschen Einbau und/oder Deletion von Nukleotiden abnorme Längen auf. Die Längenverteilung der Mikrosatelliten von Tumor-DNA kann mittels einer hochauflösenden Kapillarelektrophorese nachgewiesen und mit den Mikrosatelliten von Normalgewebe- DNA verglichen werden (Abb. 3). Die Methode ist technisch aufwendiger, zeitintensiver und teurer als eine immunhistochemische Analyse von MMR-Proteinen.<br /> Eine wenig arbeitsintensive MSI-Analyse ermöglicht jedoch die CE-invitro- Diagnostika(IVD)-gelabelte Idylla™- Plattform der Firma Biocartis. Die nur ca. zwei Minuten in Anspruch nehmende „Hands-on“-Arbeit ist auf das Einbringen eines histologischen Tumorgewebeschnittes in eine Reaktionskartusche reduziert. In der Kartusche erfolgen automatisiert DNA-Extraktion, Mikrosatelliten-PCR und Mikrosatellitensequenzanalyse mittels Schmelzpunkt-PCR.<br /> Eine molekulare MSI-Testung hat als Vorteil eine hohe diagnostische Sensitivität. Ferner kann auch bei seltenem Ausfall von MSH3 oder PMS1, welche in der diagnostischen Routine meist nicht mittels Immunhistologie analysiert werden, eine MSI detektiert werden. Nachteile bestehen im Fehlen einer Information über die Natur des für die MSI verantwortlichen Proteins beziehungsweise Gens sowie in im Vergleich zur Immunhistologie höheren Kosten und dem höheren Zeitaufwand, zumindest bei Verwendung der konventionellen Kapillarelektrophorese. Eine molekulare Mikrosatellitenanalyse wird jedoch auch zunehmend in größere „Next generation sequencing“- Panels integriert, wobei hier meist über 100 verschiedene Mikrosatelliten untersucht werden.<sup>14</sup></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Onko_1903_Weblinks_jatros_onko_1903_s63_abb3_oberndorfer.jpg" alt="" width="2150" height="1147" /></p> <h2>Sporadische MSI oder Lynch-Syndrom?</h2> <p>Bei MMR-Protein-Ausfall und MSI stellt sich die Frage, ob die Ursache auf die Tumorzellen beschränkt ist oder eine Keimbahnveränderung, respektive ein Lynch- Syndrom, vorliegt. Bei Verlust der Expression von MLH1 kann eine MLH1-Promotormethylierungsanalyse zumindest beim Kolon- und Endometriumkarzinom die Differenzierung unterstützen. Das Vorliegen einer MLH-Promotormethylierung spricht für eine nur im Tumor vorliegende Stilllegung des MLH1-Gens und gegen ein Lynch-Syndrom, bei welchem eine MLH1- Promotormethylierung nur in ca. 1 % der Fälle auftritt. Die Analyse der MLH1-Promotormethylierung umfasst meist eine Bisulfitbehandlung der Tumor-DNA. Bisulfit wandelt nicht methylierte Cytosinbasen in Uracil beziehungsweise Thymin um, während methyliertes Cytosin von der Bisulfiteinwirkung geschützt ist. Dadurch entstehen in Abhängigkeit vom Methylierungsstatus der DNA Sequenzänderungen, welche mittels Sequenzierung, insbesondere Pyrosequenzierung oder methylierungsspezifischer PCR, nachgewiesen werden können.<sup>15</sup><br /> Ferner macht beim Kolonkarzinom das Bestehen einer in circa 10 % der Fälle vorliegenden BRAF-Mutation ein Lynch-Syndrom wenig wahrscheinlich. Beim Endometriumkarzinom ist der Ausschluss eines Lynch-Syndroms durch eine BRAF-Analyse jedoch kaum möglich, weil BRAF-Mutationen beim Endometriumkarzinom mit circa 0,1 % sehr selten sind.<sup>16</sup></p> <h2>Zusammenfassung</h2> <p>Die Immunhistologie ist eine Screeningmethode zur Identifikation von MMR-defekten Tumoren. Eine molekulare MSIAnalyse kann fakultativ zur Verifizierung eines MSI-Status angeschlossen werden. Jedenfalls sollte bei MLH1- und PMS2- Proteinverlust eine <em>MLH1</em>-Promotermethylierungsanalyse ergänzt werden und beim Kolonkarzinom zusätzlich eine <em>BRAF</em>-Gensequenzierung erfolgen. Damit können Tumoren als eher sporadisch MMR-defekt oder als mit Lynch-Syndrom assoziiert eingestuft werden. Bei Verdacht auf Lynch-Syndrom sind als nächster Schritt eine genetische Beratung und Untersuchung auf den ursächlichen Gendefekt durch Keimbahnsequenzierung unter Einbeziehung der genetischen Abklärung von Angehörigen zu empfehlen.<br /> Es ist eine Zunahme der Untersuchungen auf MMR-Defekte und MSI zu erwarten, bedingt durch den vermehrten Einsatz von Immuntherapien sowie das gesteigerte Verständnis des Nutzens einer Lynch-Syndrom-Abklärung, insbesondere bei Kolon- und Endometriumkarzinomen.<sup>17</sup></p></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Baretti M, Le DT: DNA mismatch repair in cancer. Pharmacol Ther 2018; 189: 45-62 <strong>2</strong> Le DT et al.: PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372: 2509-20 <strong>3</strong> Sinicrope FA: Lynch syndrome-associated colorectal cancer. N Engl J Med 2018; 379(8): 764-73 <strong>4</strong> Ju JY et al.: Universal Lynch syndrome screening should be performed in all upper tract urothelial carcinomas. Am J Surg Pathol 2018; 42(11): 1549-55 <strong>5</strong> Yurgelun MB, Kastrinos F: Tumor testing for microsatellite instability to identify Lynch syndrome: new insights into an old diagnostic strategy. J Clin Oncol 2019; 37(4): 263-5 <strong>6</strong> Polom K et al.: Meta-analysis of microsatellite instability in relation to clinicopathological characteristics and overall survival in gastric cancer. Br J Surg 2018; 105(3): 159-67 <strong>7</strong> Bonneville R et al.: Landscape of microsatellite instability across 39 cancer types. JCO Precis Oncol 2017; 2017: 1-15 <strong>8</strong> Latham A et al.: Microsatellite instability is associated with the presence of Lynch syndrome pan-cancer. J Clin Oncol 2019; 37(4): 286-95 <strong>9</strong> Battaglin F et al.: Microsatellite instability in colorectal cancer: overview of its clinical significance and novel perspectives. Clin Adv Hematol Oncol 2018; 16(11): 735-45 <strong>10</strong> Havel JJ et al.: The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nat Rev Cancer 2019; 19(3): 133-50 <strong>11</strong> Ishikawa T et al.: Prognostic impact of MSI in stage II colon cancers: an additional translational study of the SACURA trial. J Clin Oncol 2017; 35(15_suppl): e15155 <strong>12</strong> Shia J: Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome. Part I. The utility of immunohistochemistry. J Mol Diagn 2008; 10(4): 293-300 <strong>13</strong> Zhang L: Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome: Part II. The utility of microsatellite instability testing. J Mol Diagn 2008; 10(4): 301-7 <strong>14</strong> Middha S et al.: Reliable pan-cancer microsatellite instability assessment by using targeted nextgeneration sequencing data. JCO Precis Oncol 2017(1): 1-17 <strong>15</strong> Lehmann U: DNA-Methylierung. Der Pathologe 2010; 31(2): 274-9 <strong>16</strong> Metcalf AM, Spurdle AB: Endometrial tumour BRAF mutations and MLH1 promoter methylation as predictors of germline mismatch repair gene mutation status: a literature review. Fam Cancer 2014; 13(1): 1-12 <strong>17</strong> Salvador MU et al.: Comprehensive paired tumor/germline testing for Lynch syndrome: bringing resolution to the diagnostic process. J Clin Oncol 2019; 37(8): 647-57</p>
</div>
</p>