Neutralisierende Antikörper: wenn Biologika aus dem Plasma verschwinden
Bericht:
Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Unter Therapie mit Biologika kommt es häufig zur Bildung sogenannter neutralisierender Antikörper, die an die therapeutischen Antikörper binden und deren Wirkung vollständig neutralisieren können. Dennoch ist ein Monitoring der Biologika-Spiegel in der Rheumatologie nicht üblich und wird auch nicht empfohlen. Das könnte sich nun im Lichte neuer Daten ändern.
Ungeachtet der Erfolge, die mit den verschiedenen therapeutischen Antikörpern gegen TNFα in der Behandlung entzündlich rheumatischer Erkrankungen erreicht wurden und werden, bleiben die beobachteten Effektgrößen letztlich überschaubar. Es sei „zutiefst deprimierend“, dass in Studien mit Biologika nur rund 50% der Patient:innen ein ACR50-Ansprechen erreichen, so Prof. Dr. Silje Syversen, Universität Oslo. Legt man noch strengere Kriterien wie z.B. ein ACR70-Ansprechen an, so bewegen sich die Responderraten nur in der Größenordnung von 20%. Überlegungen in Richtung einer Therapieoptimierung seien also dringend geboten. Einer der Gründe für mangelnden Therapieerfolg ist das Auftreten neutralisierender Antikörper, die an das Biologikum binden (Anti Drug Antibodies – ADAs). Dies könne bis zum vollständigen Verlust der Wirkung gehen. Syversen: „Bei hohen ADA-Konzentrationen kommt es vor, dass überhaupt kein aktives Biologikum mehr in der Zirkulation ist. Die Betroffenen sind dann praktisch unbehandelt. Trotzdem behandeln wir in der Rheumatologie alle Patient:innen mit gleichen Medikamenten-Dosierungen. In der Gastroenterologie ist man da schon weiter und individualisiert die Biologika-Dosierungen.“
Aus den vorhandenen Therapien das Beste herausholen
Hier kommt nun das Konzept des Therapeutic Drug Monitoring (TDM) ins Spiel, erläutert Syversen. Dieses besteht in Kontrollen der Wirkstoffspiegel sowie möglicher ADAs, gefolgt von möglichen Dosisanpassungen. Es gehe darum, „aus den verfügbaren Medikamenten das Beste herauszuquetschen“, so Syversen. Daher heißt eine Internationale Forschungsgruppe, die sich unter anderem mit dem Problem der ADAs beschäftigt, „Squeeze Consortium“. Squeeze wird vom EU-Projekt „Horizon Europe“ finanziert und besteht aus mittlerweile 15 Partnern in verschiedenen europäischen Ländern. Daten von mehr als 30000 Patient:innen stehen für Auswertungen zur Verfügung, ein Budget von 12,5 Millionen Euro ist aktuell verfügbar. Squeeze führte bzw. führt drei klinische Studien durch. Zu den Aufgaben von Squeeze zählt nicht nur Forschung zum Thema TDM, sondern u.a. auch zur Identifikation von Biomarkern, die die Prädiktion eines Ansprechens auf bestimmte Therapien ermöglichen, sowie zur Therapie-Adhärenz. Dies alles mit dem Ziel, die Wirksamkeit und Sicherheit krankheitsmodifizierender antirheumatischer Therapien (DMARDs) im klinischen Alltag zu verbessern.1
Ob und in welchem Ausmaß es zum Auftreten neutralisierender Antikörper gegen die therapeutischen Antikörper kommt, hängt von einer Reihe unterschiedlicher Faktoren ab. In einer skandinavischen Studie erwiesen sich die Diagnose einer rheumatoiden Arthritis (RA) und Rauchen (auch für Exraucher) als Prädiktoren für das Auftreten von ADAs gegen Infliximab. Im Gegensatz dazu waren die Diagnose einer Spondylarthritis sowie die konkomitante Einnahme immunmodulierender Medikamente mit einem niedrigen Risiko für das Auftreten von ADAs assoziiert. Auch längere „Drug Holidays“ erwiesen sich als ungünstig. Höhere Infliximab-Dosen sowie höhere Infliximab-Spiegel im Serum zeigten dagegen einen protektiven Effekt.2 Auch ein bestimmter genetischer Hintergrund (HLA-DQ2) ist mit dem Auftreten von ADAs assoziiert.3 Während die Messung der Wirkstoffspiegel im Plasma verlässlich und durch die gebräuchlichen Assays reproduzierbar ist, bestehen bei den ADAs erhebliche Schwierigkeiten durch schlechte Vergleichbarkeit unterschiedlicher Assays sowie durch Beeinflussung der Testergebnisse durch den Wirkstoff.
Syversen: „Wir kennen die Variabilität der Wirkstoffspiegel. Wir kennen die Beziehung zwischen Wirkstoffspiegel und klinischem Ansprechen. Wir kennen die therapeutischen Bereiche und Assays sind verfügbar.“ Damit steht einem breiten klinischen Einsatz von Therapeutic Drug Monitoring nichts mehr im Wege. TDM bedeutet letztlich eine Personalisierung der Therapie, zumal bei hohen Plasma-Spiegeln des Wirkstoffs auch Biologika-Dosierungen reduziert werden können, was sich letztlich in einer Reduktion der Behandlungskosten niederschlägt.4
Therapeutic Drug Monitoring verbessert klinische Ergebnisse
Als letzter Stein im Evidenzpuzzle konnte mittlerweile auch gezeigt werden, dass Therapeutic Drug Monitoring die klinischen Ergebnisse verbessert. Im Rahmen der NOR-DRUM(NORwegian DRUg Monitoring)-Studie, der bislang größten Untersuchung zum Einsatz von TDM, wurden Patient:innen mit immunmediierten inflammatorischen Erkrankungen in einen TDM-Arm sowie in einen Standard-Arm mit Infliximab-Standard-Dosierung randomisiert. Im TDM-Arm wurden Anpassungen von Infliximab-Dosierungen und Dosis-Intervallen anhand der gemessenen Serum-Spiegel und des Auftretens von ADAs vorgenommen. Der primäre Endpunkt war anhaltende Krankheitskontrolle ohne Krankheitsverschlechterung. Dieser wurde im TDM-Arm von 73,6% der Patient:innen und im Standard-Arm von 55,9% der Patient:innen erreicht. Dies entspricht einer geschätzten, adjustierten Differenz von 17,6% (95% CI: 9,0–26,2%; p<0,001) zugunsten von Therapeutic Drug Monitoring. Diesem Vorteil in der Wirksamkeit standen keine vermehrten Nebenwirkungen gegenüber. Syversen betont, dass die Ergebnisse bei sämtlichen Diagnosen konsistent waren, wobei der Studie allerdings die Power für statistisch aussagekräftige Subgruppenanalysen fehlte.5
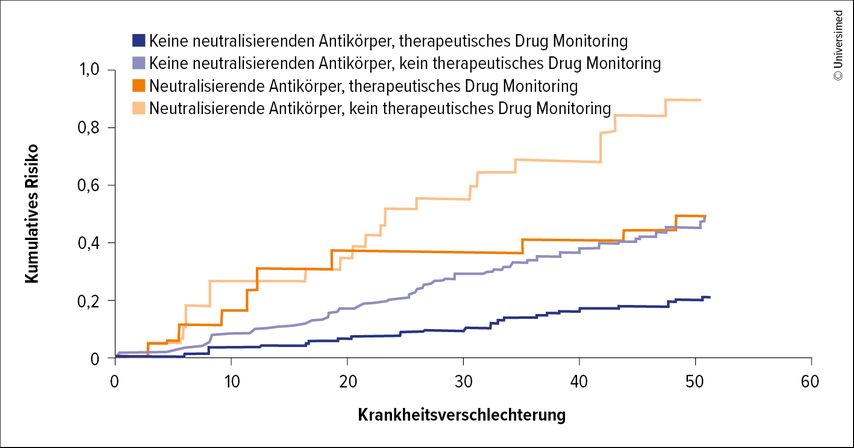
Weitere Auswertungen der Daten zeigten, dass Patient:innen in der TDM-Gruppe, bei denen keine ADAs auftraten, mit großem Abstand die besten Chancen auf anhaltende Krankheitskontrolle hatten. Im Gegensatz dazu schnitten Patient:innen aus dem Kontrollarm mit ADAs am schlechtesten ab. Bei Patient:innen mit ADAs aus dem Standard-Arm kam es auch am häufigsten zum Auftreten von Infusions-Reaktionen.6 Die Daten zeigen also, so Syversen, dass TDM die Nachteile, die den Betroffenen durch das Auftreten von ADAs entstehen, durch TDM weitgehend kompensieren (Abb. 1).
Syversen unterstreicht allerdings, dass diese Daten ausschließlich mit Infliximab generiert wurden, während für TDM mit subkutanen Anti-TNF-Therapien oft nur anekdotische Evidenz besteht. Entsprechende Studien befinden sich jedoch in Planung. Für die multizentrische, internationale Studie RA-Drum mit Adalimumab hat das Recruiting bereits begonnen.
Erste vorsichtige Empfehlungen für Kontrolle der Wirkstoffspiegel
Angesichts der aktuellen Datenlage können jedoch allenfalls schwache Empfehlungen für TDM gegeben werden. Die EULAR veröffentlichte zum Thema TDM im Jahr 2022 „points to consider“, die besagen, dass TDM in Betracht gezogen werden kann, wenn es beispielsweise zu Flares kommt. Ein routinemäßiger Einsatz von TDM wird allerdings explizit nicht empfohlen.7
Syversen weist allerdings darauf hin, dass zum Zeitpunkt der Publikation die Daten aus NOR-DRUM noch nicht verfügbar waren. Ein rezenter Review gelangt jedoch zu dem Ergebnis, dass Evidenz mit geringer Sicherheit darauf hindeutet, dass proaktives TDM bei Patient:innen unter Erhaltungs-Therapie mit Infliximab den Anteil der Patient:innen, die stabile Krankheitskontrolle erreichen, erhöhen kann. Es wird allerdings auch darauf hingewiesen, dass keine entsprechende Evidenz für eine Induktionstherapie mit Infliximab oder eine Therapie mit Adalimumab vorliegt.8
Auf dieser Basis wurden im British Medical Journal Empfehlungen für TDM in der Behandlung von inflammatorischen Darmerkrankungen, inflammatorischer Arthritis oder Psoriasis mit Infliximab veröffentlicht.9 Diese beruhen jedoch auf schwacher Evidenz, da NOR-DRUM eine offene Studie war, und können nicht auf andere Biologika übertragen werden.
Ebenfalls relevant: Wirkstoffspiegel von Methotrexat
Wirkstoffspiegel sind jedoch nicht nur für die Biologika-Therapien relevant, so Dr. Leonhard Heinz, Medizinische Universität Wien. Das klassische konventionelle DMARD in der Rheumatologie ist Methotrexat, das sowohl als Monotherapie als auch als Kombinationspartner verschiedener Biologika die First-Line-Therapie bei verschiedenen entzündlich-rheumatischen Erkrankungen darstellt. Methotrexat verstärkt die Wirkung vieler Biologika – unter anderem, weil es der Bildung neutralisierender Antikörper entgegenwirkt. Ungeachtet seiner hohen klinischen Bedeutung wird der Wirkmechanismus von MTX nach wie vor nicht vollständig verstanden. Sicher ist, dass MTX Folat antagonisiert und damit die Produktion von Methyldonatoren sowie Adenosin-Signaling beeinflusst. Darüber hinaus reduziert MTX die Produktion von Zytokinen und Adhäsions-Molekülen sowie von reaktiven Sauerstoff-Spezies. MTX gelangt über einen Transporter (SLC19A1/RFC1) in die Zelle und wird dort sofort zum biologisch aktiveren MTX-Polyglutamat metabolisiert. Dies geschieht über das Enzym Folylpolyglutamat-Synthase (FPGS), das physiologisch ATP-abhängig L-Glutamat-Reste an reduzierte Folsäure-Derivate ligiert. Damit greift MTX bereits in den Folat-Stoffwechsel ein. Das entstehende MTX-Polyglutamat inhibiert eine Reihe von Folat-abhängigen Prozessen, wie zum Beispiel die De-novo-Synthesen von Purin und Pyrimidin. Diese Prozesse dürften im Falle einer Inflammation zur Reduktion der Immunaktivierung beitragen. Die Bioverfügbarkeit von MTX wird mit 70% angegeben, scheint jedoch starken individuellen Schwankungen zu unterliegen, zumal die Metabolisierung nicht über FPGS erfolgen muss und andere Enzyme biologisch inaktive MTX-Metaboliten erzeugen. Auch bestimmte Spezies von Darmbakterien können MTX inaktivieren.10
MTX-Polyglutamat akkumuliert in den Zellen über mehrere Wochen, bis ein konstanter Spiegel erreicht wird, und gelangt kaum ins Plasma. Eine Messung des aktiven MTX-Metaboliten ist daher schwierig. Andererseits würde sich MTX-Polyglutamat sehr gut als Biomarker für die Dosierung von MTX eignen, da die Konzentrationen von MTX-Polyglutamat gut mit der Wirksamkeit der Therapie sowie mit Toxizitäten korrelieren. Weder stehen jedoch Messmethoden für den klinischen Alltag zur Verfügung, noch liegen validierte Grenzwerte vor. Ein Messverfahren, das MTX-Polyglutamat in Erythrozyten mittels Massenspektrometrie quantifizieren soll, wird gegenwärtig unter Mitwirkung der Medizinischen Universität Wien entwickelt. Die Messung von MTX-Spiegeln wird im Squeeze Consortium vorangetrieben.
Nichtinvasiver Test: MTX-Messung aus dem Fingerschweiß
Allerdings wird auch ein unkonventioneller, nichtinvasiver Ansatz verfolgt: die Messung von MTX-Metaboliten aus dem Fingerschweiß. Heinz unterstreicht, dass dies ein einfach anwendbares Verfahren werden könnte, mit dem sich beispielsweise die Adhärenz überprüfen lässt. Am Institut für Analytische Chemie der Universität Wien ist es mittlerweile gelungen, Koffein und seine Metaboliten im Fingerschweiß nachzuweisen und zu quantifizieren. Die Pro-band:innen müssen dazu nur ein Stück Filterpapier für kurze Zeit zwischen den Fingern halten. Der Schweiß wird in der Folge extrahiert und analysiert. Der Fingerschweiß ist in seiner Zusammensetzung der Interstitial-Flüssigkeit sehr ähnlich und hat im Vergleich zum Plasma eine Reihe von Vorteilen. So ist er weitgehend frei von Proteinen und Lipiden, was die Analytik erleichtert.
Eine Pilotstudie zeigt mittlerweile, dass es möglich ist, MTX und seine Metaboliten im Fingerschweiß nachzuweisen. Dabei wurde auch ein Vergleich zwischen subkutanem und oralem MTX durchgeführt. Erste, noch unpublizierte Daten lassen unter anderem auf die unterschiedliche Pharmakokinetik der beiden Applikationsmethoden schließen. Eine Studie mit einer größeren Zahl an Proband:innen wird aktuell geplant. Eingeschlossen sollen RA-Patient:innen werden, die unter einer Monotherapie mit einer stabilen MTX-Dosis stehen. In dieser Population soll die MTX-Therapie bei Bedarf durch Umstellung auf subkutanes MTX oder eine Erhöhung der oralen Dosis optimiert werden. Die klinische Evaluation wird von Messungen der Wirkstoffspiegel begleitet, die auch Informationen zur Einsetzbarkeit der Fingerschweiß-Analyse in der Klinik liefern sollen.
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation, Sitzung „Precision Medicine in Rheumatology“, Prof. Dr. Silje Syversen, am 28. November in Wien
Literatur:
1 www.squeeze-project.eu 2 Brun MK et al.: Risk factors for anti-drug antibody formation to infliximab: secondary analyses of a randomised controlled trial. J Intern Med 2022; 292(3): 477-91 3 Brun MK et al.: HLA-DQ2 is associated with anti-drug antibody formation to infliximab in patients with immune-mediated inflammatory diseases. JIntern Med 2023; 293(5): 648-55 4 Syversen SW et al.: Therapeutic drug monitoring: a tool to optimize treatment of inflammatory joint diseases. Arthritis Rheumatol 2024; 76(5): 667-9 5 Syversen SW et al.: Effect of therapeutic drug monitoring vs standard therapy during maintenance infliximab therapy on disease control in patients with immune-mediated inflammatory diseases: arandomized clinical trial. JAMA 2021; 326(23): 2375-84 6 Brun MK et al.: Clinical consequences of infliximab immunogenicity and the effect of proactive therapeutic drug monitoring: exploratory analyses of the randomised, controlled NOR-DRUM trials. Lancet Rheumatol 2024; 6(4): e226-e236 7 Krieckaert CL et al.: EULAR points to consider for therapeutic drug monitoring of biopharmaceuticals in inflammatory rheumatic and musculoskeletal diseases. Ann Rheum Dis 2023; 82(1): 65-73 8 Zeraatkar D et al.: Proactive therapeutic drug monitoring of biologic drugs in patients with inflammatory bowel disease, inflammatory arthritis, and psoriasis: systematic review and meta-analysis. BMJ Med 2024; 3(1): e000998 9 Kawano-Dourado L et al.: Proactive therapeutic drug monitoring of biologic drugs in adult patients with inflammatory bowel disease, inflammatory arthritis, or psoriasis: a clinical practice guideline. BMJ 2024; 387: e079830 10 Brown PM et al.: Mechanism of action of methotrexate in rheumatoid arthritis, and the search for biomarkers. Nat Rev Rheumatol 2016; 12(12): 731-42
Das könnte Sie auch interessieren:
Gezielte Therapien bei axSpA – und wie aus ihnen zu wählen ist
Nachdem 2003 der erste TNF-Blocker zugelassen wurde, existiert heute für die röntgenologische (r-axSpA) und die nichtröntgenologische axiale Spondyloarthritis (nr-axSpA) eine ganze Reihe ...
Vermehrt auch in Österreich: genetische Hämoglobinopathien
Angesichts der aktuellen Migrationsbewegungen in und um Europa besteht vermehrt die Möglichkeit, im klinischen Alltag mit in Mitteleuropa bisher sehr seltenen genetischen Erkrankungen ...
ACR 2024: klinische Studien und das Placeborätsel
Zwischen 15. und 19. November fand in Washington die jährliche Convergence des American College of Rheumatology (ACR) statt. Im Rahmen der Jahrestagung der Österreichischen Gesellschaft ...